RNA polymerase beta Antibody 货号: CY7097-100ul 品牌: Abways 标签: 一抗
规格信息
| 品牌: |
Abways |
|---|---|
| CAS: |
N/A |
| 规格: |
100ul |
| 货期: |
3天 |

RNA polymerase beta Antibody 货号: CY7097-100ul 品牌: Abways 标签: 一抗
| 品牌: |
Abways |
|---|---|
| CAS: |
N/A |
| 规格: |
100ul |
| 货期: |
3天 |
PureXtract RNAsol RNA 分离溶液介绍
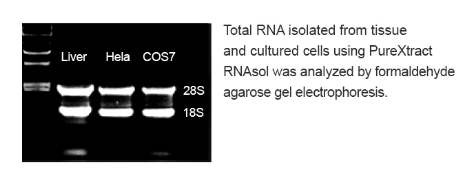
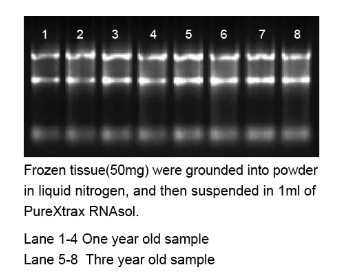

norgenbiotek唾液RNA收集和保存装置怎么样
Norgen的唾液RNA收集和保存设备旨在1)简单和非侵入性的唾液收集和2)在环境温度下保存唾液样本中的RNA。唾液样本通过在收集漏斗内吐痰来收集,该收集漏斗已与收集管组装在一起。在收集到所需体积的唾液后,取下收集漏斗,然后加入防腐剂安瓿的内容物并与收集的唾液混合。唾液收集管随后被送到实验室进行RNA分离和分析。保存样品中的唾液RNA在室温下可稳定长达2个月。该试剂盒是收集和保存RNA样本进行流行病学和人群研究的理想选择。
特点和优势
保存的RNA在室温下可稳定长达2个月
样品收集和保存在一个方便的套件中 样本没有传染性,
可以在环境温度下安全处理和运输
非侵入性、用户友好的收集,
适合自我收集
省事且经济高效-无需冷藏运输/储存
与RNA分离方法兼容
保存与任何下游应用兼容的高质量RNA
提供CE-IVD标记版本
使用 LumiZol 试剂快速分离 RNA、DNA 和蛋白质
LumiZol Reagent 设计用于从各种来源(植物、动物、细菌和酵母)的细胞和组织样品中快速分离 RNA、DNA 和蛋白质。 LumiZol Reagent 是一种含有苯酚、异硫氰酸胍以及分离高质量核酸和蛋白质所需的其他成分的溶液。苯酚和异硫氰酸胍可裂解细胞并有效抑制核糖核酸酶,从而保持 RNA 完整。均质化并添加氯仿后,样品分离成上层水相、中间相和下层有机相。 RNA 可以用异丙醇从上相沉淀,而 DNA 和蛋白质可以分别用乙醇和异丙醇从中间相和下层有机相沉淀。
植物和动物组织——30-100毫克;
贴壁真核细胞 — 1×10 5至 1×10<sup7< sup=”” style=”box-sizing: border-box;”>;
悬浮真核细胞、酵母 — 5×10 6至 10×10 6;
细菌细胞 — 1×10 7。
使用新鲜或液氮速冻样品以获得最佳 RNA 分离效果。在 LumiZol 试剂中均质化之前,请勿解冻样品。
根据您的起始材料在 LumiZol 试剂中裂解样品:
组织:在 1 mL LumiZol 试剂中匀浆组织样本,并将匀浆转移至新的 1.5 mL 管中。
细胞:弃去培养基,用 0.5–1 mL LumiZol 试剂重悬细胞沉淀或单层细胞,然后将裂解物转移至新的 1.5 mL 试管中。
(可选)如果样品脂肪含量高,则将裂解液在 4 °C 下以 12,000 × g 离心 5 分钟,然后将上清液转移至新的 1.5 mL 管中。
将管在室温下孵育 5 分钟。
向裂解液中添加 0.2 mL 氯仿(每 1 mL 用于裂解的 LumiZol 试剂),通过翻转管充分混合,并在室温下孵育 2 分钟。
将管在 4°C 下以 12,000 × g 离心 15 分钟。离心后,混合物分成两相:无色水相和黄色有机相,其间有中间相。
将上层水相转移至新的 1.5 mL 管中,不要接触间相。如果样品中RNA的量非常少,则在水相中添加共沉淀剂。保留有机相和界面用于 DNA 和蛋白质提取。
向水相中加入0.8体积的异丙醇,充分混合,并在室温下孵育10分钟。
将管在 4°C 下以 12,000 × g 离心 10 分钟。
弃去上清液,向 RNA 沉淀中加入 1 mL 70% 乙醇,充分混匀,并在 4 °C 下以 7,500 × g离心管 5 分钟。
弃去上清液,将 RNA 沉淀风干 5-10 分钟。
将 RNA 沉淀溶解在 50–100 μL 无 RNase 水中。
除去“RNA 分离”部分步骤 5 中获得的界面上的任何剩余水相。
向界面相和有机相中添加 0.3 mL 100% 乙醇(每 1 mL 《RNA 分离》步骤 1 中使用的 LumiZol 试剂),通过翻转管混合,并在室温下孵育 2-3 分钟。
将管在 4 °C 下以 2,000 × g 离心 5 分钟。将上清液转移至新的 1.5 mL 管中。上清液可用于后续的蛋白质提取。
将 DNA 沉淀重悬于 1 mL 柠檬酸钠/乙醇溶液(10% 乙醇中的 0.1 M 柠檬酸钠,pH 8.5)中。
孵育 30 分钟,偶尔混合。
将管在 4 °C 下以 2,000 × g 离心 5 分钟。丢弃上清液。
再重复一次步骤 4-6。
将 1 mL 70% 乙醇添加到 DNA 沉淀中,充分混匀,然后在 4 °C 下以 2,000 × g离心管 5 分钟。
弃去上清液,将 DNA 沉淀风干 5-10 分钟。
将 DNA 沉淀重悬于 0.3–0.6 mL 的 8 mM 氢氧化钠中。
将管在 4 °C 下以 12,000 × g 离心 10 分钟,将上清液转移至新的 1.5 mL 管中,并用 Tris-HCl 缓冲液将 pH 调节至 7–8 [添加 5 μL 1 M Tris-HCl 缓冲液(pH 4.5)至300μL DNA溶液]。
向《DNA 分离》部分第 3 步获得的上清液中添加 1.5 mL 异丙醇(每 1 mL 《RNA 分离》步骤 1 中使用的 LumiZol 试剂),通过翻转管充分混合,并孵育 10分钟在室温下。
将管在 4°C 下以 12,000 × g 离心 10 分钟。丢弃上清液。
将蛋白质沉淀重新悬浮在 2 mL 盐酸胍/乙醇溶液(0.3 M 盐酸胍于 95% 乙醇中)中。
将管在室温下孵育 20 分钟。
将管在 4 °C 下以 7,500 × g 离心 5 分钟。丢弃上清液。
再重复步骤 3-5 两次。
向蛋白沉淀中加入 2 mL 100% 乙醇,充分混匀,室温孵育 20 分钟。
将管在 4 °C 下以 7,500 × g 离心 5 分钟。丢弃上清液。
将蛋白质沉淀风干 5-10 分钟。
将蛋白质沉淀溶解在含有 SDS 的缓冲液中(例如,用于将蛋白质样品加载到聚丙烯酰胺凝胶上的样品缓冲液)。
可电离脂质的应用——RNA 递送
可电离脂质是一类有机脂质分子,在生理 pH 值下呈中性,在酸性 pH 值下呈质子化 (+)。可电离的脂质与磷脂、胆固醇和聚乙二醇化脂质一起构成脂质纳米颗粒 (LNP) 的结构。
可电离脂质在 LNP 中发挥作用,可保护 RNA 免受水解、核酸酶、pH 突然变化和氧化损伤的降解,以促进其胞质转运(图 1)。本质上,可电离脂质有助于促进 RNA 递送至靶细胞。
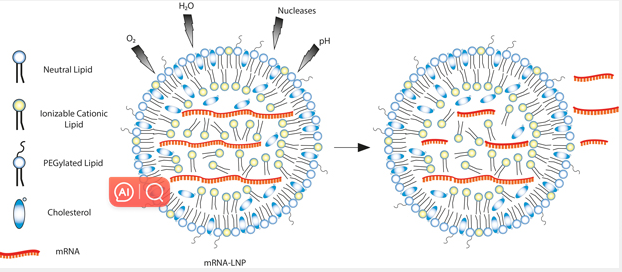
图 1:LNP 复合物中的可电离脂质发挥作用,促进 mRNA 胞质转运至靶细胞中。
从结构上看,目前有五种主要的可电离脂质类型广泛用于 RNA 递送;不饱和、多尾、聚合、可生物降解和支化尾(表 1)。
不饱和可电离脂质通过增加双层脂质形成非双层相的倾向来增强膜破坏,以及随后的有效负载释放。双层脂质的这种转变趋势是尾部饱和度从 0 个顺式双键增加到 2 个顺式双键的结果。例如,MC3(表 1,第 1 行)的每个尾部都有两个顺式双键,MC3证明了不饱和可电离脂质能够增强 LNP 将 RNA 递送至靶细胞的能力,从而重新点燃了治疗学中 RNA 递送的热情,特别是 mRNA 疫苗。
多尾可电离脂质通过产生增加尾部区域横截面积的锥形 LNP 结构来增强内体破坏以及随后的 RNA 递送。因此,在使用此类脂质的同时优化 LNP 结构可以提高 RNA 效力。例如,C12-200(表 1,第 2 行)是一种多尾离子化脂质,与标准制剂相比,mRNA 表达量增加了 7 倍。这种使用多尾可电离脂质的优化配方被用于各种 mRNA 递送目的,特别是产前蛋白质替代疗法。
聚合可电离脂质通过疏水聚集增强颗粒形成,从而增强 RNA 递送。这种通过疏水聚集的增强是通过将游离胺取代到具有烷基尾部的阳离子聚合物上来实现的。例如,G0-C14(表 1,第 3 行)通过赋予肿瘤中各种 RNA 治疗剂的高积累/效力和有效转染,证明了 LNP 在癌症治疗中的前景。
![]()
可生物降解的电离脂质可减少细胞内 RNA 成功递送后的持续积累和毒性。这对于需要重复给药的 RNA 疗法尤其重要。这种降低的毒性是通过包含酯键来实现的,因为它们在生理pH下稳定,但在组织和细胞内会水解。例如,L319(表 1,第 4 行)是通过用酯键替换每个MC3尾部中的一个双键而制成的。这保持了 RNA 有效负载的效力,同时显示出宿主更好的耐受性。
支尾可电离脂质通过增强内体逃逸和增加脂质尾部的横截面积来增加 RNA 递送效力。由于 RNA 递送的多方面增强,支尾可电离脂质可有效递送大型 mRNA 构建体,用于蛋白质补充和碱基编辑疗法等。例如,FTT5(表 1,第 5 行)展示了具有酯链的支尾可电离脂质如何比其线性类似物具有更高的转染效率。与直链尾巴相比,支链尾巴的这种较高效率可能是由于支链可电离脂质上存在的仲酯的降解速率较慢。
作为脂质供应商,BroadPharm提供多种可电离脂质,例如ALC-0315类似物、SM-102类似物、MC3、C12-200等,为我们的客户在纳米颗粒药物输送方面的高级研究提供支持。