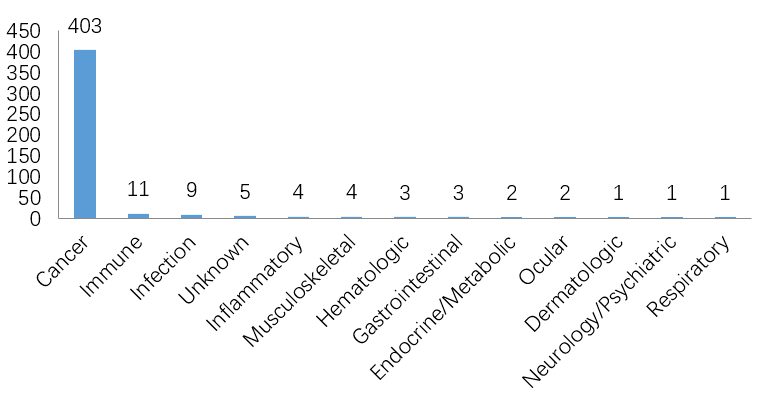
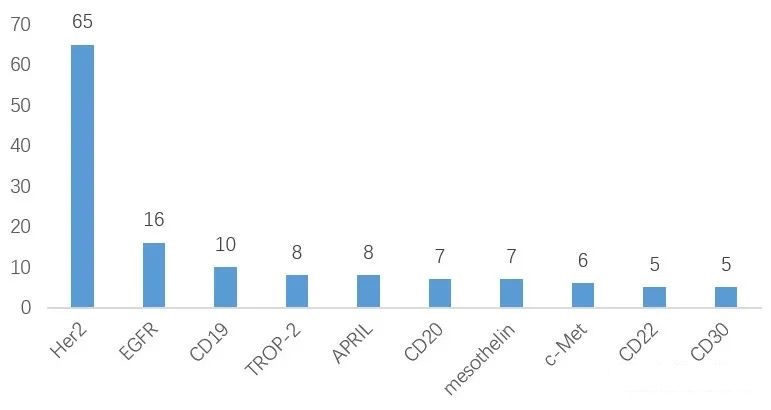
抗体药物制备过程中最需要注意的事项有哪些?
抗体偶联药物是通过连接体将针对特定抗原的单克隆抗体与小分子细胞药物连接而成。它既具有传统小分子化疗的强大杀伤作用,又具有抗体药物的肿瘤靶向特性。自从第一个ADC(Mylotarg)被批准用于治疗CD33阳性急性髓系白血病以来,已经开发了几种用于治疗癌症的ADC。
从选择合适的抗体到最终产品,ADC的整个开发过程是一项艰巨且富有挑战性的任务。临床药理学是药物开发最重要的工具之一。使用该工具有助于找到产品的最佳剂量,从而保持产品在患者群体中的安全性和有效性。与其他小分子或大分子通常仅测量一个部分/代谢物进行药代动力学分析不同,ADC 需要测量多个部分来表征其 PK 特性。因此,深入了解 ADC 的临床药理学对于在患者群体中选择安全有效的剂量至关重要。
ADC 药代动力学概述
药代动力学是临床药理学和现代药物开发重要的一部分。药代动力学研究的主要目的是获得吸收、分布容积、清除率、半衰期、多次给药后的蓄积、各种疾病状态以及年龄、体重和性别对药物药代动力学的影响。信息。这些药代动力学参数可用于为患者设计最佳给药方案。
应该认识到,与小分子和治疗性蛋白(抗体/融合蛋白)不同,ADC 的 PK 非常复杂,因为 ADC 由多种成分组成。不仅要考虑单克隆抗体的PK,还要考虑细胞毒性分子的PK以及结合的物理和化学性质。由于单克隆抗体的分子量占90%以上,ADC不同成分的PK受其PK影响较大。总抗体 (ADC+mAb) 的 PK 特性提供了 ADC 稳定性和完整性的最佳评估。缀合物和偶联位点在维持 ADC 的稳定性和 PK 方面也发挥着重要作用。下表列出了 FDA 批准的 ADC 的特性和 PK。
ADC的药代动力学特征
一般来说,给药后体内会涉及四个过程。这些过程是吸收、分布、分解代谢和清除。
吸收
大多数抗体通常通过静脉注射或输注的方式给予,也可以通过皮下途径给予抗体。然而,对于ADC来说,目前的给药途径是静脉注射或输注。由于对细胞毒性有效负载的反应和细胞毒性物质的局部沉积,SC 给药可能不适合 ADC。
分配
药物在体内的分布可以用分布容积来描述。由于其大小和极性,抗体和 ADC 的分布通常仅限于血管和细胞间隙。
ADC的初始分布一般局限于血管内,分布体积一般等于血容量。随后,ADC 可以分布到间隙空间。此外,ADC的分布也会受到靶抗原表达和内吞作用的影响。
ADC在同一组织中的分布和积累可产生不良(毒性)药理作用,这是由于摄入ADC后细胞毒性药物或代谢物的释放。
分解代谢
ADC体内分解或代谢过程包括体内抗体分解代谢和小分子药物代谢。 ADC 在到达肿瘤细胞之前在细胞(不可切割连接体)或循环系统(可切割连接体)中释放效应分子。未结合的抗体和抗体片段沿着抗体的代谢途径,通过酶水解产生氨基酸,并被人体重复利用。
ADC裂解或分解代谢后可能形成的游离小分子药物/带有氨基酸残基的小分子药物/连接体的小分子药物代谢物将进一步经过肝脏CYP450酶代谢,潜在的药物也可能发生相互作用。
除了ADC本身的性质外,抗原表达、受体/细胞密度、FcRn介导的循环、Fcγ相互作用、受体介导的内吞作用、免疫原性等都会影响ADC的分解代谢。
清除
ADC也通过分解代谢和排泄被消除。 ADC通过特定途径进入溶酶体后可被降解,与靶标结合,释放出小分子药物后从体内清除;它也可以通过非特异性胞饮作用被清除,这涉及到 FcRn 的回收过程。
ADC、抗体、分子量较大的肽和氨基酸片段不能通过肾小球过滤和排泄,而是以氨基酸的形式被重新吸收和利用。游离的小分子药物、分子量较小的肽和氨基酸连接的小分子药物、分子量较小的抗体片段等可通过肾小球滤过排出体外。同时,小分子药物和代谢物也可以通过酶代谢消除或通过转运蛋白排泄到粪便中。
ADC 生物分析
ADC有多种成分,要表征这些成分的PK特性,需要几种分析方法,如下所述:
1.ELISA免疫分析测定结合物和总抗体的动力学曲线。
2.TFC-MS/MS,定量游离药物/代谢物。
3.高分辨质谱用于体内药物抗体比分析。
此外,有两种类型的 ELISA 免疫测定用于定量测量 ADC 分析物:第一种类型的分析测量总抗体,即 DAR 大于或等于零的 ADC。第二种分析方法测量药物结合抗体,定义为 DAR 大于或等于 1 的 ADC。
其他分析方法有尺寸排阻色谱法 (SEC) 和疏水相互作用色谱法 (HIC)。 SEC 是常用的液相色谱 (LC) 技术,用于确定聚集抗体的数量。该技术也可用于 ADC。尽管 HIC 是一种用于蛋白质分离、纯化和表征的传统技术,但该技术现在正用于 ADC 表征和分析。
细胞毒性有效负载
ADC细胞毒性有效负载应具有以下特征:
1.分子的有效负载应该小,缺乏免疫原性,并且可溶于水缓冲液,以便它们可以很容易地偶联。
2.细胞毒有效负载应具有适当的脂溶性。
3.有效负载的目标应位于小区内部。
4.有效负载在血液中应稳定。
目前,常用的细胞毒性药物效应分子有微管抑制剂(auristatins/maytansinoids)、DNA损伤剂(卡利刹霉素/duocarmycins/anthracyclines/吡咯并苯二氮卓二聚体)和DNA转录抑制剂(Amatoxin/Quinolinealkaloid(SN-38))。已批准上市的几款ADC药物总共使用了6种不同的小分子药物,其中3款ADC药物使用MMAE作为结合药物,2种药物使用卡利车霉素作为结合药物。 MMAF、DM1、SN-38、Dxd也被成功使用。
药物抗体比(DAR)
DAR 是指单个单克隆抗体上附着的有效负载分子的平均数量,通常在 2 至 4 个分子之间。在极少数情况下,通过使用亲水连接器有效负载(例如 Enhertus 和 Trodelvys)可以安全地实现高达 8 的 DAR。 DAR对于ADC的疗效判定非常重要,DAR可能影响药物在循环中的稳定性、PK以及ADC的毒性。
研究表明,与DAR值<6的ADC相比,DAR值高(7-14)的ADC具有更快的清除率和较低的体内疗效。 DAR 值及其对稳定性和 PK 的影响还取决于偶联位置和连接子的大小。
通常对赖氨酸或半胱氨酸进行修饰来生产ADC。赖氨酸是连接底物和抗体常用的氨基酸残基之一。赖氨酸通常存在于抗体表面,因此很容易偶联。
其他氨基酸如半胱氨酸、酪氨酸也可以修饰,利用马来酰亚胺修饰半胱氨酸合成ADC如Adcetriss、Polivys、Padcevs、Enhertus、Trodelvys和Blenreps。
链接器
Linker是ADC重要的组成部分,决定着ADC的药物释放机制、PK、治疗指标和安全性。早期的 ADC 连接体化学不稳定,例如二硫化物和腙。这些连接体在循环中不稳定,半衰期短,通常为一到两天。最新一代的连接体在体循环中更加稳定,例如肽和葡萄糖醛酸连接体。最常见的两种连接器如下:
可切割接头
裂解接头对细胞内环境敏感,通过细胞内分解代谢和解离的联合作用释放游离的效应分子和抗体,如酸裂解接头和蛋白酶裂解接头。它们通常在血液中稳定,但会在低 pH 值和富含蛋白酶的溶酶体环境中快速裂解,释放效应分子。此外,如果效应分子可以跨膜,则可以通过发挥潜在的旁观者效应来消除肿瘤。
不可切割的接头
不可切割连接子是新一代连接子。与可裂解接头相比,它具有更好的血浆稳定性。由于不可切割接头可以比可切割接头提供更高的稳定性和耐受性,因此这些接头可以减少脱靶毒性,并提供更大的治疗窗口。
免疫原性
在针对8种ADC的11项临床试验中,ADA的基线发生率在1.4%至8.1%之间,基线后ADA的发生率在0-35.8%之间。这些值在治疗性单克隆抗体的范围内。一般来说,血液肿瘤患者中 ADC 的 ADA 发生率低于实体瘤患者;大多数 ADA 都是针对 ADC 的单克隆抗体结构域。此外,在大多数患者中,这些 ADC 的半抗原样结构不会比治疗性单克隆抗体带来更大的免疫反应风险。
ADC药代动力学模型
应用模型方法可以整合PK、疗效和安全性数据,满足ADC药物研发不同阶段的需求,如:靶点选择、抗体亲和力、接头稳定性、动物对人的外推、剂量选择和调整、ER由于ADC具有多种清除途径(解离和分解代谢)以及多种分析物复杂的PK特性,其动力学模型也较为复杂。
不同的型号有不同的应用。例如,二室模型和PBPK模型可以用来描述ADC的稳定性特征,参数包括清除率、解离率和代谢率等。目前ADC药代动力学研究主要采用非房室模型、群体药代动力学模型、基于机制的模型、基于生理的模型等。
概括
在ADC药物的研发过程中,临床药理学起着非常重要的作用。通过生物分析技术的不断发展,全面地阐明ADC药物的PK/PD特性,对于推动更多低毒、高效的ADC药物的研发具有重要意义。重要的。 ADC药物也将在肿瘤治疗领域展现出更强大的优势。