上海金畔社生物科技有限公司日本同仁化学dojindo全线产品代理 中国代理商
关联产品

上海金畔社生物科技有限公司日本同仁化学dojindo全线产品代理 中国代理商
关联产品

上海金畔社生物科技有限公司日本同仁化学dojindo全线产品代理 中国代理商
特点:
● 整个标记过程仅需3个小时
● 整个标记过程在1支过滤管中进行
● 荧光标记抗体回收率高
● 适用于50-200 μg的IgG


试剂盒内含

产品概述
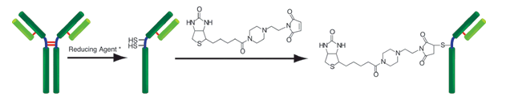
生物素标记试剂盒-SH是用于在具有SH基团的蛋白质(尤其是抗体)上标记生物素的试剂盒。由于试剂盒中包含的SH反应性生物素分子中具有马来酰亚胺基团,因此仅通过与具有SH基团的分子混合即可形成稳定的共价键。如果蛋白质具有S-S键,则可以使用连接的还原剂制备游离的SH基团。(但是,由于SS键的断裂,蛋白质的活性可能会丢失。)当用生物素标记高分子量蛋白质(例如免疫球蛋白G(IgG))时,可以使用所附的过滤管轻松进行预采样。如果可以进行处理并且将铰链区中的SH基团用于标记,则可以制备生物素标记的还原IgG,而不会损害抗体活性。另外,未反应的SH-反应性生物素可以在反应后通过使用滤管的纯化操作除去。
原理
操作步骤
使用注意事项:
1. 用该试剂盒标记的蛋白质的分子量要>50,000。
2. 在标记过程中,IgG或者Biotin-IgG标记物始终存在于过滤管的滤膜上。
3. 如果蛋白质溶液中含有分子量>10,000的其他蛋白质,如BSA或明胶时,在使用该试剂盒标记前,先要纯化IgG溶液。IgG溶液能够用IgG Purification Kits (不包含于本试剂盒中) 来纯化。
4. 如果蛋白质溶液含有小的不溶物,离心后取上清液来进行标记。
5. 1管SH-Reactive Biotin可以标记50-200ug蛋白质。
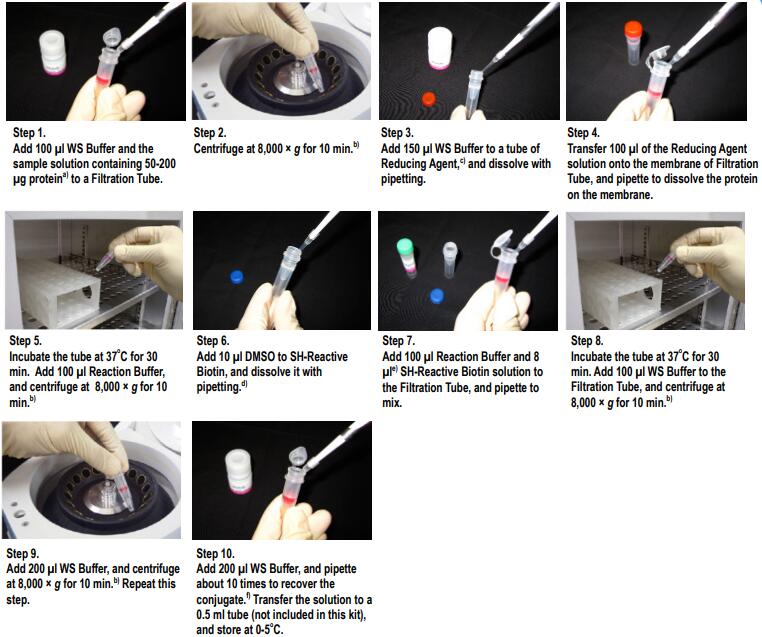
标记IgG操作步骤
(1)将100μl WS buffer以及含有100μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟。b)
(3)将150μl WS buffer加入到Reducing agent管中,并用移液器吹打使其溶解。
(4)将100μl Reducing agent溶液转移到过滤管的滤膜上,吹打使IgG在膜上溶解。
(5)37℃培养30分钟。加入100μl Reaction buffer,8,000-10,000g离心10分钟。b)
(6)将10μl DMSO加入到SH-reactive biotin中,吹打使其溶解。c)
(7)将100μl Reaction buffer与8μl SH-reactive biotin溶液加入到过滤管中,吹打使其混合。d)
(8)37℃培养30分钟。将100μl WS buffer加入到过滤管中8,000-10,000g离心10分钟。 b)
(9)加入200μl WS buffer,8,000-10,000g离心10分钟。b)再重复该步骤一次。
(10)加入200μl WS buffer,吹打10-15次来回收标记产物。e)将该溶液转移到0.5ml试管中,在0-5℃下保存。
a) 样品溶液的体积不应超过100ul。如果蛋白质浓度<0.5mg/ml,重复操作步骤1和2直至总的IgG聚积量达到100ug。如果聚积过程中滤液的体积超过400 ul,则在进行后续的离心操作前应除去滤液。
b) 如果溶液在离心后仍然残留在膜上,可以再离心5min或者适当增加转速直至膜上没有残留液体。
c) NH2-Reactive Biotin/SH-Reactive Biotin在管子的底部,向管底加入10ul DMSO,吹打数次使其溶解。
d) 如果IgG的量为200ug,在步骤4时加入所有的NH2-ReactiveBiotin溶液。
e) 并不一定要使用WS Buffer来回收标记产物,可以选择任何适合于该实验的缓冲液来替代。
产品优势
1、整个标记过程仅需3个小时
2、整个标记过程在1支过滤管中进行
3、荧光标记抗体回收率高
4、适用于50-200 μg的IgG
常见问题Q&A
| Q1:样品溶液中的共存会影响反应吗? |
| A:它可能会受到共存类型的影响。确认溶液中包含哪种物质后,根据情况纯化用于标记的蛋白质,并将其用于标记反应。<聚合物:分子量10,000以上>它可能会影响。即使使用Filtration Tube,也无法去除具有氨基的高分子量化合物,例如BSA和明胶。因此,它被标记并充当荧光杂质。 在反应中使用之前,请执行单独的清除操作。另一方面,如果存在许多高分子杂质,即使没有氨基的化合物也可能导致过滤器堵塞。它可能会干扰标记/纯化操作。 *不仅对于生物素标记试剂盒-SH,而且对于其他标记试剂盒,都需要采取相同的预防措施。 |
| Q2:标记小分子蛋白质(分子量50,000或以下)的方法。 |
| A:由于该试剂盒中包含的过滤管是分子量截断值为30K的超滤过滤器,因此我们建议使用50,000或分子量更大的蛋白质,并留有余量。当标记分子量为50,000或更小的蛋白质时,可以通过更换为分子量分数较小的超滤过滤器来标记甚至很小的蛋白质,如下所示。
—————————————— PALL Nanocep 3K产品编号OD003C33 PALL Nanocep 10K产品编号OD010C33 —————————————— 离心所需的时间可能比试剂盒中随附的过滤器要长,因此请注意离心时间。 |
| Q3:标记后,离心过滤管,液体仍会留在膜上怎么处理? |
| A:(1)目视检查隔膜时,如果液体稍微残留在隔膜杯的边缘,请继续执行下面操作。如果倾斜和旋转膜杯时液体残留在膜上或滴下,请以8,000 g离心约15至30分钟。 (2)即使在1)中的离心操作之后,如果液体仍留在膜上,请检查标记物质是否聚集。
根据抗体或蛋白质本身的特性,用小分子标记剂进行标记可能会增加抗体或蛋白质的疏水性并使其聚集。如果在标记的物质上观察到团聚,将其转移到另一个微管中一次,离心并使用上清液。 (回收的抗体/蛋白质的量将减少。)如果上述方法没有帮助,请与公司技术支持联系。 *如果您怀疑过滤器堵塞,可以通过更换新的膜过滤器来解决。 替代品:PALL Nanocep 30K(制造商代码:OD030C33) |
| Q4:该试剂盒可以标记什么? |
| A:可以标记分子量为“50,000或更高”并且具有[S-S]或[SH]的任何化合物(抗体,蛋白质等)。量为“50-200μg”。 *由于试剂盒中包含的过滤管尺寸为30K,因此无法纯化低分子量化合物。 |
参考文献
1) E. Terasaka, K. Yamada, P.H. Wang, K. Hosokawa, R. Yamagiwa, K. Matsumoto, S. Ishii, T. Mori, K. Yagi, H. Sawai, H. Arai, H. Sugimoto, Y. Sugita, Y. Shiro and T. Tosha, “Dynamics of nitric oxide controlled by protein complex in bacterial system”, Proc. Natl. Acad. Sci. U.S.A.., 2017, 114, (37), 9888.
2) J. Hiruma, K. Harada, A. Motoyama, Y. Okubo, T. Maeda, M. Yamamoto, M. Miyai, T. Hibino and R. Tsuboi, “Key component of inflammasome, NLRC4, was identified in the lesional epidermis of psoriatic patients”, J. Dermatol.., 2018, 45, (8), 971.
3) K. Gonda, M. Watanabe, H. Tada, M. Miyashita, Y. Takahashi-Aoyama, T. Kamei, T. Ishida, S. Usami, H. Hirakawa, Y. Kakugawa, Y. Hamanaka, R. Yoshida, A. Furuta, H. Okada, H. Goda, H. Negishi, K. Takanashi, M. Takahashi, Y. Ozaki, Y. Yoshihara, Y. Nakano and N. Ohuchi, “Quantitative diagnostic imaging of cancer tissues by using phosphor-integrated dots with ultra-high brightness”, Sci. Rep.., 2017, 7, (1), 7509.
4) K. Saito, M. Sakaguchi, H. Iioka, M. Matsui, H. Nakanishi, N.H. Huh and E. Kondo, “Coxsackie and adenovirus receptor is a critical regulator for the survival and growth of oral squamous carcinoma cells”, Oncogene., 2014, 33, (10), 127401286.
5) K. Yamamoto, H. Murata, E.W. Putranto, K. Kataoka, A. Motoyama, T. Hibino, Y. Inoue, M. Sakaguchi and N.H. Huh, “DOCK7 is a critical regulator of the RAGE-Cdc42 signaling axis that induces formation of dendritic pseudopodia in human cancer cells”, Oncol. Rep.., 2013, 29, (3), 1073.
6) M. Sakaguchi, H. Murata, K. Yamamoto, T. Ono, Y. Sakaguchi, A. Motoyama, T. Hibino, K. Kataoka and N.H. Huh, “TIRAP, an Adaptor Protein for TLR2/4, Transduces a Signal from RAGE Phosphorylated upon Ligand Binding”, PLoS ONE., 2011, 6, (8), e23132.
7) M. Sakaguchi, H. Murata, Y. Aoyama, T. Hibino, E.W. Putranto, I.M. Ruma, Y. Inoue, Y. Sakaguchi, K. Yamamoto, R. Kinoshita, J. Futami, K. Kataoka, K. Iwatsuki and N.H. Huh, “DNAX-activating Protein 10 (DAP10) Membrane Adaptor Associates with Receptor for Advanced Glycation End Products (RAGE) and Modulates the RAGE-triggered Signaling Pathway in Human Keratinocytes”, J. Biol. Chem.., 2014, 289, (34), 23389.
8) N. Kobayashi, K. Odaka, T. Uehara, K. Imanaka-Yoshida, Y. Kato, H. Oyama, H. Tadokoro, H. Akizawa, S. Tanada, M. Hiroe, T. Fukumura, I. Komuro, Y. Arano, T. Yoshida and T. Irie, “Toward in Vivo Imaging of Heart Disease Using a Radiolabeled Single-Chain Fv Fragment Targeting Tenascin-C”, Anal. Chem.., 2011, 83, (23), 9123.
9) T. Ikeda, R. Shinohata, M. Murakami, K. Hina, S. Kamikawa, S. Hirohata, S. Kusachi, A. Tamura and S. Usui, “A rapid and precise method for measuring plasma apoE-rich HDL using polyethylene glycol and cation-exchange chromatography: a pilot study on the clinical significance of apoE-rich HDL measurements”, Clin. Chim. Acta.,2017, 465, 112.
10) T. Into, M. Inomata, M. Nakashima, K. Shibata, H. Hacker and K. Matsushita, “Regulation of MyD88-Dependent Signaling Events by S Nitrosylation Retards Toll-Like Receptor Signal Transduction and Initiation of Acute-Phase Immune Responses”, Mol. Cell. Biol.., 2008, 28, (4), 1338.
11) W. Nakai, T. Yoshida, D. Diez, Y. Miyatake, T. Nishibu, N. Imawaka, K. Naruse, Y. Sadamura and R. Hanayama, “A novel affinity-based method for the isolation of highly purified extracellular vesicles”, Sci. Rep.., 2016, 6, 33935.
12) Y. Terasaki, T. Akuta, M. Terasaki, T. Sawa, T. Mori, T. Okamoto, M. Ozaki, M. Takeya and T. Akaike, “Guanine Nitration in Idiopathic Pulmonary Fibrosis and Its Implication for Carcinogenesis”, Am. J. Respir. Crit. Care Med.., 2006, 174, (6), 665.
13) I. W. Sumardika, C. Youyi, E. Kondo, Y. Inoue, I. M. W. Ruma, H. Murata, R. Kinoshita, K. Yamamoto, S. Tomida, K. Shien, H. Sato, A. Yamauchi, J. Futami, E. W. Putranto, T. Hibino, S. Toyooka , M. Nishibori and M. Sakaguchi, “β-1,3-Galactosyl-O-Glycosyl-Glycoprotein β-1,6-N-Acetylglucosaminyltransferase 3 Increases MCAM Stability, Which Enhances S100A8/A9-Mediated Cancer Motility.”, Oncol. Res., 2018, 26, (3), 431.
14) J. Iwano, D. Shinmi, K. Masuda, T. Murakami and J. Enokizono, “Impact of Different Selectivity between Soluble and Membrane-bound Forms of Carcinoembryonic Antigen (CEA) on the Target-mediated Disposition of Anti-CEA Monoclonal Antibodies.”, Drug Metab. Dispos., 2019, 47, (1), 1240.
15) D. S. On, P. Chertchinnapa, Y. Shinkai, T. Kojima and H. Nakano, “Development of a dual monoclonal antibody sandwich enzyme-linked immunosorbent assay for the detection of swine influenza virus using rabbit monoclonal antibody by Ecobody technology.”, J. Biosci. Bioeng., 2020, DOI:10.1016/j.jbiosc.2020.03.003.
上海金畔社生物科技有限公司日本同仁化学dojindo全线产品代理 中国代理商

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Biotin Labeling Kit – NH2 生物素标记-氨基
NO.2. Cell Counting Kit-8 细胞增殖毒性检测
NO.3. Viability/Cytotoxicity Multiplex Assay Kit 细胞活性/毒性双重检测
NO.4. Fluorescein Labeling Kit – NH2 FITC(488激发)标记-氨基
NO.5. Biotin Labeling Kit – SH 生物素标记-巯基
上海金畔社生物科技有限公司日本同仁化学dojindo全线产品代理 中国代理商
特点:
● 生物素标记的产品可以在大约2小时内制备。
● 只需将NH2反应性生物素与目标蛋白混合即可形成稳定的共价键。
● 可以标记分子量为50,000或更高的蛋白质。
● 可以标记50-200μg的蛋白质。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● 生物素标记的产品可以与试剂盒中包含的存储溶液一起存储。

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
NO.3. Fluorescein Labeling Kit – NH2 荧光素标记试剂盒-氨基
NO.4. Peroxidase Labeling Kit – NH2 过氧化物酶标记试剂盒-氨基
NO.5. Biotin Labeling Kit – NH2 (for 1mg) 生物素标记试剂盒-氨基
试剂盒内含

产品概述
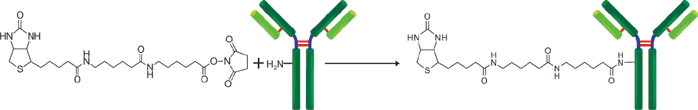
生物素标记试剂盒-NH2是用于用生物素标记带有氨基基团的蛋白质的试剂盒,尤其是抗体,由于该试剂盒中包含的NH2-反应性生物素分子中具有活性酯基,因此仅通过与生物素混合即可形成稳定的共价键。当生物素标记在蛋白质(例如免疫球蛋白G(IgG))上时,可以使用随附的过滤管轻松去除抑制标记反应和未反应的NH2-反应性生物素的低分子量化合物(例如Tris)。因此,没有必要进行诸如透析和凝胶过滤的处理,并且可以以高回收率获得高纯度的标记化合物。
原理
操作步骤
使用注意事项:
1. 用本试剂盒标记的蛋白质的分子量要>50,000。
2. 在标记过程中,IgG或者Biotin-IgG标记物始终存在于过滤管的滤膜上。
3. 如果IgG溶液中含有分子量>10,000的其他蛋白质,如BSA或明胶时,在使用该试剂盒标记前,先要纯化IgG溶液。IgG溶液能够用IgG Purification Kits (不包含于本试剂盒中) 来纯化。
4. 如果IgG溶液含有小的不溶物,离心后取上清液来进行标记。
5. 1管NH2-Reactive Biotin可以标记50-200 ug蛋白质。
标记IgG操作步骤
(1)将100μl WS buffer以及含有100μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟。b)
(3)将10μl DMSO加入到NH2-reactive biotin中并用移液器吹打使其溶解。c)
(4)将100μl Reaction buffer以及8μl NH2-reactive biotin溶液加入到过滤管中,吹打使其混合。d)
(5)将过滤管放入培养箱中,37℃培养10分钟。
(6)将100μl WS buffer加入到过滤管中,8,000-10,000g离心10分钟,b)除去滤液。
(7)将200μl WS buffer加入到过滤管中,8,000-10,000g离心10分钟,b)重复该步骤一次。
(8)将200μl WS buffer加入到过滤管中吹打10-15次来回收标记产物。e)将该溶液转移到0.5ml试管中,在0-5℃下保存。

a) 样品溶液的体积不应超过100ul。如果蛋白质浓度低于0.5mg/ml,重复操作步骤1和2直至总的蛋白质聚积量达到50-200ug。如果聚积过程中滤液的体积超过400ul,则在进行后续的离心操作前应除去滤液。
b) 如果溶液在离心后仍然残留在膜上,可以再离心5min或者适当增加转速直至膜上没有残留液体。
c) NH2-Reactive Biotin在管子的底部,向管底加入10ul DMSO,吹打数次使其溶解。
d) 如果蛋白质的量为200ug,在操作步骤4时加入所有的NH2-Reactive Biotin-DMSO溶液。
e) 并不一定要使用WS Buffer来回收标记产物,可以选择任何适合于该实验的缓冲液来替代。
产品优势
1)生物素标记的产品可以在大约2小时内制备。
2)只需将NH2反应性生物素与目标蛋白混合即可形成稳定的共价键。
3)可以标记分子量为50,000或更高的蛋白质。
4)可以标记50-200μg的蛋白质。
5)可以通过使用过滤管的分离操作以高回收率获得标记物质。
6)生物素标记的产品可以与试剂盒中包含的存储溶液一起存储。
常见问题Q&A
| Q1:这个试剂盒可以用于标记其他蛋白质吗? |
| A:可以。但是如果含有像血清白蛋白或者明胶的蛋白,标记反应可能会受到干扰。用这个试剂盒标记之前,有必要先纯化抗体溶液。如果您想进一步了解纯化过程可以联系我们。 |
| Q2:我只有少量的IgG,可以标记吗? |
| A:在该试剂盒中,标记所需的IgG量为50至200μg。
在此范围内,性能没有太大差异。 可以用10μg IgG进行标记,但是可能会出现诸如背景升高的问题。 |
| Q3:样品溶液中的共存会影响反应吗? |
| A:它可能会受到共存类型的影响。确认溶液中包含哪种物质后,根据情况纯化用于标记的蛋白质,并将其用于标记反应。
<聚合物:分子量10,000以上>它可能会影响。即使使用Filtration Tube,也无法去除具有氨基的高分子量化合物,例如BSA和明胶。因此,它被标记并充当荧光杂质。 在反应中使用之前,请执行单独的清除操作。另一方面,如果存在许多高分子杂质,即使没有氨基的化合物也可能导致过滤器堵塞。它可能会干扰标记/纯化操作。 *生物素标记试剂盒-不仅需要对NH2采取相同的预防措施,还需要对其他标记试剂盒采取相同的预防措施。 |
| Q4:标记小分子蛋白质(分子量50,000或以下)的方法。 |
| A:由于该试剂盒中包含的过滤管是分子量截断值为30K的超滤过滤器,因此我们建议使用50,000或分子量更大的蛋白质,并留有余量。
当标记分子量为50,000或更小的蛋白质时,可以通过更换为分子量分数较小的超滤过滤器来标记甚至很小的蛋白质,如下所示。 —————————————— PALL Nanocep 3K产品编号OD003C33 PALL Nanocep 10K产品编号OD010C33 —————————————— 离心所需的时间可能比试剂盒中随附的过滤器要长,因此请注意离心时间。 |
| Q5:标记后,离心过滤管,液体仍会留在膜上怎么处理? |
| A:(1)目视检查隔膜时,如果液体稍微残留在隔膜杯的边缘,请继续执行下面操作。如果倾斜和旋转膜杯时液体残留在膜上或滴下,请以8,000 g离心约15至30分钟。
(2)即使在1)中的离心操作之后,如果液体仍留在膜上,请检查标记物质是否聚集。根据抗体或蛋白质本身的特性,用小分子标记剂进行标记可能会增加抗体或蛋白质的疏水性并使其聚集。如果在标记的物质上观察到团聚,将其转移到另一个微管中一次,离心并使用上清液。 (回收的抗体/蛋白质的量将减少。) *如果您怀疑过滤器堵塞,可以通过更换新的膜过滤器来解决。 替代品:PALL Nanocep 30K(制造商代码:OD030C33) |
| Q6:该试剂盒可以标记什么? |
| A:可以标记分子量为“ 50,000或更高”和反应性氨基(NH2)的化合物(抗体,蛋白质等)。标记样品量为“50-200μg”。
*当考虑标记“ mg”的量时,也可以使用“生物素化试剂盒(Sulfo-OSu);同仁产品货号:BK01”。 *由于试剂盒附带的过滤管为30K,因此无法纯化低分子量化合物。 |
| Q7:一个IgG分子能标记多少生物素? |
| A:每个IgG分子平均能标记7至10个生物素。 |
| Q8:标记产物能保存多久? |
| A:在0-5℃下能够保存2个月。如果需要保存更久,可以添加等量的丙三醇,并在-20℃下 (只要该蛋白可以冷冻) 存放。但是,还要注意样品自身是否稳定。 |
| Q9:能不能用这个试剂盒标记寡核苷酸和寡肽? |
| A:不能,寡核苷酸和寡肽的分子量太小不能使其保留在过滤膜上。请参照Q4。 |
| Q10:含有生物素标记蛋白质的活细胞怎么处理? |
| A:我们推荐使用PBS (含2-10% FBS) 制备细胞悬液,保持最佳细胞状态。 |
| Q11:回收缓冲液 (WS Buffer)对活细胞有危害吗? |
| A:没有。WS Buffer含有表面活性剂,它的浓度控制在对细胞没有毒性的范围内。如果您担心WS Buffer中的添加剂,请您使用常用的缓冲液代替。 |
参考文献
1) Y. Kubota, Y. Oike, S. Satoh, Y. Tabata, Y. Niikura, T. Morisada, M. Akao, T. Urano, Y. Ito, T. Miyamoto, N. Nagai, G. Y. Koh, S. Watanabe and T. Suda, “Cooperative Interaction of Angiopoietin-like Proteins 1 and 2 in Zebrafish Vascular Development “, Proc. Natl. Acad. Sci. USA, 2005, 102(38), 13502.
2) T. Yamabuki, A. Takano, S. Hayama, N. Ishikawa, T. Kato, M. Miyamoto, T. Ito, H. Ito, Y. Miyagi, H. Nakayama, M. Fujita, M. Hosokawa, E. Tsuchiya, N. Kohno, S. Kondo, Y. Nakamura and Y. Daigo, “Dikkopf-1 as a Novel Serologic and Prognostic Biomarker for Lung and Esophageal Carcinomas”, Cancer Res., 2007, 67, 2517.
3) H. Kohara, Y. Omatsu, T. Suhiyama, M. Noda, N. Fujii and T. Nagasawa, “Development of Plasmacytoid Dendritic Cells in Bone Marrow Stromal Cell niches Requires CXCL12-CXCR4 Chemokine Signaling”, Blood, 2007, 110(13), 4153.
4) N. Ishikawa, A. Takano, W. Yasui, K. Inai, H. Nishimura, H. Ito, Y. Miyagi, H. Nakayama, M. Fujita, M. Hosokawa, E. Tsuchiya, N. Kohno, Y. Nakamura and Y. Daigo, “Cancer-testis Antigen Lymphocyte Antigen 6 Complex Locus K is a Serologic Biomarker and a Therapeutic Target for Lung and Esophageal Carcinomas”, Cancer Res., 2007, 67(24), 11601.
5) A. Fukuda, T. Goto, K.N. Kuroishi, K.K. Gunjigake, S. Kataoka, S. Kobayashi and K. Yamaguchi, “Hemokinin-1 competitively inhibits substance P-induced stimulation of osteoclast formation and function”, Neuropeptides., 2013, 47, (4), 251.
6) A. Ogawa , M. Sakatsume, X. Wang, Y. Sakamaki, Y. Tsubata, B. Alchi, T. Kuroda, H. Kawachi, I. Narita, F. Shimizu and F. Gejyo, “SM22alpha: the novel phenotype marker of injured glomerular epithelial cells in anti-glomerular basement membrane nephritis”, Nephron Exp. Nephrol.., 2007, 106, (3), e77.
7) D. Men, T.T. Zhang, L.W. Hou, J. Zhou, Z.P. Zhang, Y.Y. Shi, J.L. Zhang, Z.Q. Cui, J.Y. Deng, D.B. Wang and X.E. Zhang, “Self-Assembly of Ferritin Nanoparticles into an Enzyme Nanocomposite with Tunable Size for Ultrasensitive Immunoassay”, ACS Nano., 2015, 9, (11), 10852.
8) D. Sugahara, Y. Kobayashi, Y. Akimoto, H. Kawakami, “Mouse intestinal niche cells express a distinct α1,2-fucosylated glycan recognized by a lectin from Burkholderia cenocepacia”, Glycobiology., 2017, 27, (3), 246.
9) H. Sasaki-Iwaoka, M. Ohori, A. Imasato, K. Taguchi, K. Minoura, T. Saito, K. Kushima, E. Imamura, S. Kubo, S. Furukawa and T. Morokata, “Generation and characterization of a potent fully human monoclonal antibody against the interleukin-23 receptor”, Eur. J. Pharmacol.., 2018, 828, 89.
10) K. Kaneshiro, M. Watanabe, K. Terasawa, H. Uchimura, Y. Fukuyama, S. Iwamoto, T.A. Sato, K. Shimizu, G. Tsujimoto and K. Tanaka, “Rapid quantitative profiling of N-glycan by the glycan-labeling method using 3-aminoquinoline/α-cyano-4-hydroxycinnamic acid”, Anal. Chem.., 2012, 84, (16), 7146.
11) K.S. Tan, K. Kulkeaw, Y. Nakanishi, D. Sugiyama, “Expression of cytokine and extracellular matrix mRNAs in fetal hepatic stellate cells”, Genes Cells., 2017, 22, (9), 836.
12) M. Tahara, S. Ohno, K. Sakai, Y. Ito, H. Fukuhara, K. Komase, M.A. Brindley, P.A. Rota, R.K. Plemper, K. Maenaka and M. Takeda, “The receptor-binding site of the measles virus hemagglutinin protein itself constitutes a conserved neutralizing epitope”, J. Virol.., 2013, 87, (6), 3583.
13) M. Takahashi, Y. Ishida, D. Iwaki, K. Kanno, T. Suzuki, Y. Endo, Y. Homma and T. Fujita, “Essential role of Mannose-binding lectin-associated serine protease-1 in activation of the complement factor D”, J. Exp. Med.., 2010, 207, (1), 29.
14) N. Hosen, Y. Matsunaga, K. Hasegawa, H. Matsuno, Y. Nakamura, M. Makita, K. Watanabe, M. Yoshida, K. Satoh, S. Morimoto, F. Fujiki, H. Nakajima, J. Nakata, S. Nishida, A. Tsuboi, Y. Oka, M. Manabe, H. Ichihara, Y. Aoyama, A. Mugitani , T. Nakao, M. Hino, R. Uchibori, K. Ozawa, Y. Baba, S. Terakura, N. Wada, E. Morii, J. Nishimura, K. Takeda, Y. Oji, H. Sugiyama, J. Takagi and A. Kumanogoh, “The activated conformation of integrin β7 is a novel multiple myeloma-specific target for CAR T cell therapy”, Nat. Med.., 2017, 23, (12), 1436.
15) R. Nishino, A. Takano, H. Oshita, N. Ishikawa, H. Akiyama, H. Ito, H. Nakayama, Y. Miyagi, E. Tsuchiya, N. Kohno, Y. Nakamura and Y. Daigo, “Identification of Epstein-Barr virus–induced gene 3 as a novel serum and tissue biomarker and a therapeutic target for lung cancer”, Clin. Cancer Res.., 2011, 17, (19), 6272.
16) T. Hiono, A. Matsuda, T. Wagatsuma, M. Okamatsu, Y. Sakoda and A. Kuno, “Lectin microarray analyses reveal host cell-specific glycan profiles of the hemagglutinins of influenza A viruses”, Virology., 2019, 527, 132.
17) T. Oshima, S. Sato, J. Kato, Y. Ito, T. Watanabe, I. Tsuji, A. Hori, T. Kurokawa and T. Kokubo, “Nectin-2 is a potential target for antibody therapy of breast and ovarian cancers”, Mol. Cancer., 2013, 12, (60), .
18) T. Yoshida, N. Shiraki, H. Baba, M. Goto, S. Fujiwara, K. Kume and S. Kume, “Expression patterns of epiplakin1 in pancreas, pancreatic cancer and regenerating pancreas”, Genes Cells., 2008, 13, (7), 667.
19) X. Piao, T. Ozawa, H. Hamana, K. Shitaoka, A. Jin, H. Kishi and A. Muraguchi, “TRAIL-receptor 1 IgM antibodies strongly induce apoptosis in human cancer cells in vitro and in vivo”, Oncoimmunology., 2016, 5, (5), e1131380.
20) Y. Shimazaki, Y. Kohno, “Successive analysis of antigen trapping and enzymatic digestion on membrane-immobilized avidin”, Anal. Biochem.., 2012, 422, (1), 55.
关联产品
实验工具|稀释计算器|摩尔浓度计算器
上海金畔社生物科技有限公司日本同仁化学dojindo全线产品代理 中国代理商
特点:
● 享有显色底物WST专利
● 用于L-Glutamate的定量

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. FerroOrange 细胞亚铁离子检测
NO.2. Glutamine Assay Kit-WST 谷氨酰胺的定量检测
NO.3. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽定量
NO.4. Liperfluo 细胞脂质过氧化物检测
NO.5. Mito-FerroGreen 铁离子荧光探针
试剂盒内含

产品概述
谷氨酸不仅用于蛋白质和谷胱甘肽的生物合成,而且还作为神经递质发挥重要作用,谷氨酸过多被认为是引起神经退行性疾病如阿尔茨海默氏病的原因。根据文献报道,胱氨酸/谷氨酸的转运蛋白(xCT)具有吸收胱氨酸放出谷氨酸的功能,而抑制xCT会诱导细胞发生铁依赖性的死亡—铁死亡,近年来针对xCT的癌症研究越来越多。
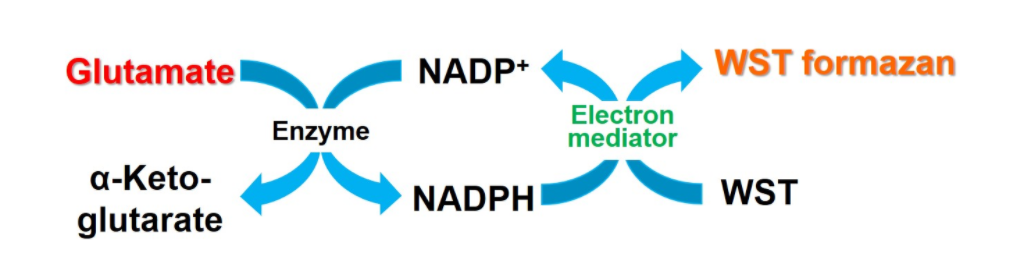
Glutamate Assay Kit-WST是谷氨酸的定量检测试剂盒。细胞培养基中或细胞内的谷氨酸都可以通过WST的还原反应进行定量,谷氨酸定量的最低浓度为5 μmol/l。此外,本试剂盒还可以使用96孔板进行多样品批量检测。
原理
本试剂盒通过WST的还原反应对细胞和培养基中的谷氨酸进行定量。此外,本试剂盒还包含谷氨酸标准溶液,可用于通过制作标准曲线来定量样品中谷氨酸的浓度。
操作步骤
只需将细胞培养上清液或组织/细胞裂解溶液转移到孔板中,加入试剂后孵育即可。

实验例
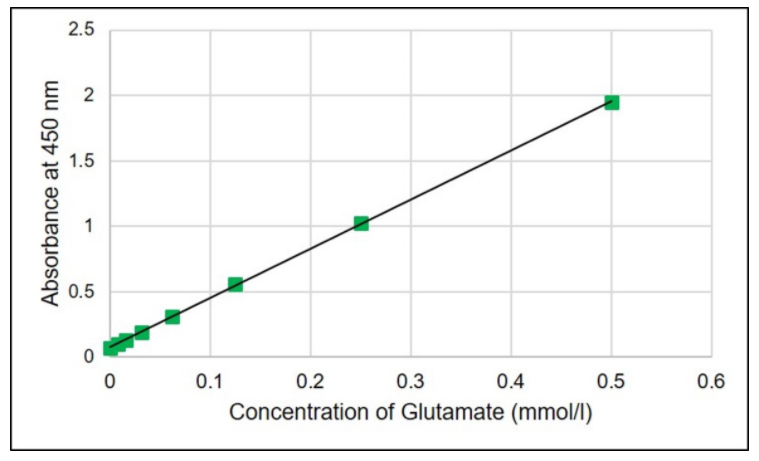
标准曲线的实验例:
样品中的谷氨酸浓度可通过使用该试剂盒的谷氨酸标准溶液制作标准曲线来确定。如果谷氨酸浓度为0.5 mmol/l或更高,则可以通过稀释样品进行检测。
谷氨酰胺和谷氨酸的检测实验例:
将A549细胞接种在6孔板中,用Glutamine Assay Kit-WST和Glutamate Assay Kit-WST分别检测细胞培养上清液中谷氨酰胺和谷氨酸浓度随培养时间的变化。
结果,培养基中的谷氨酰胺浓度随培养时间增加而降低,而谷氨酸浓度则升高。

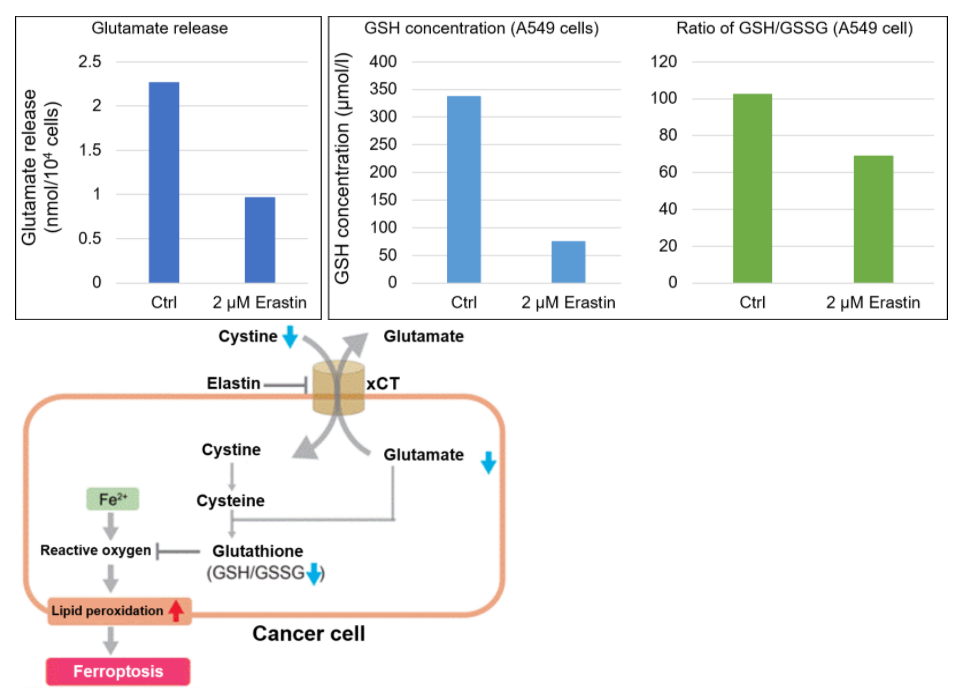
铁死亡研究中谷氨酸和谷胱甘肽的检测实验例:
据报道通过弹性蛋白,抑制胱氨酸/谷氨酸转运体(xCT)造成铁依赖性的细胞死亡,即细胞铁死亡。在通过弹性蛋白处理后的A549细胞中,确认谷氨酸的释放量和细胞内谷胱甘肽的量。结果显示,通过弹性蛋白处理的细胞中谷氨酸释放的量减少,抑制胱氨酸的摄取,从而导致谷胱甘肽的量减少。
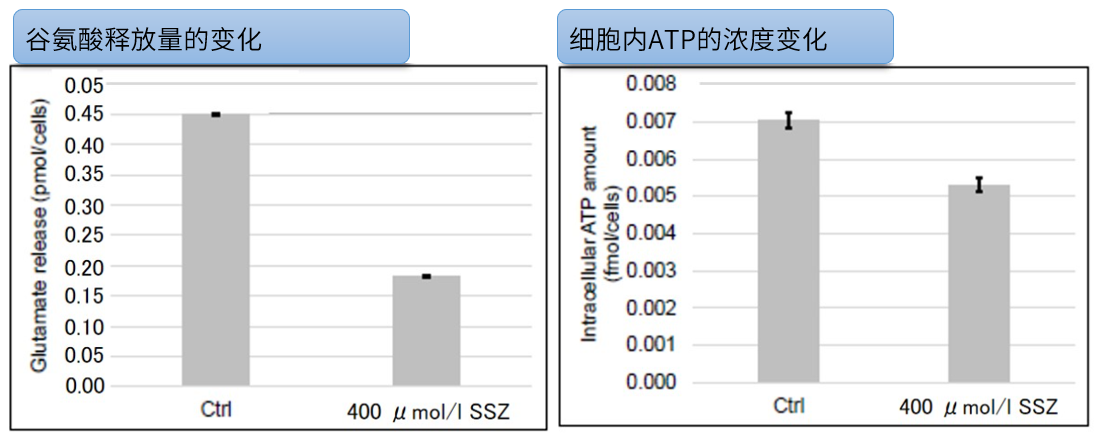
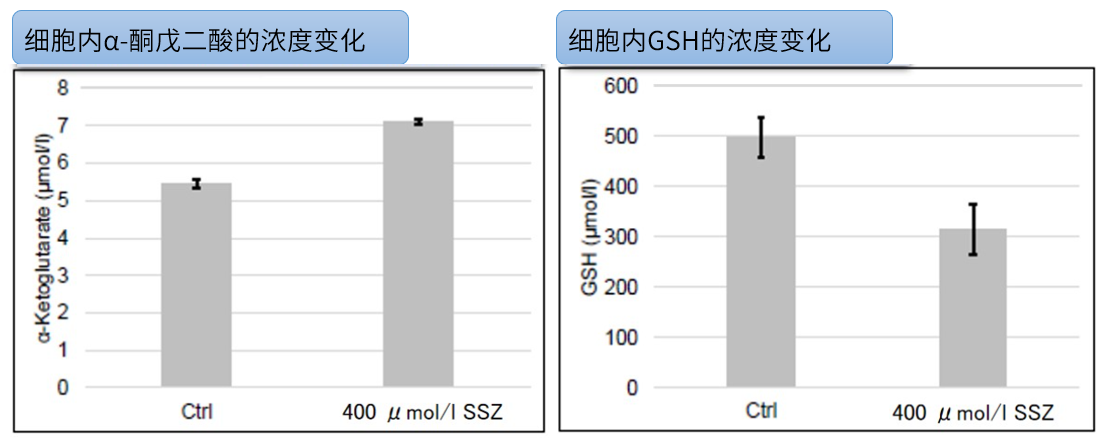
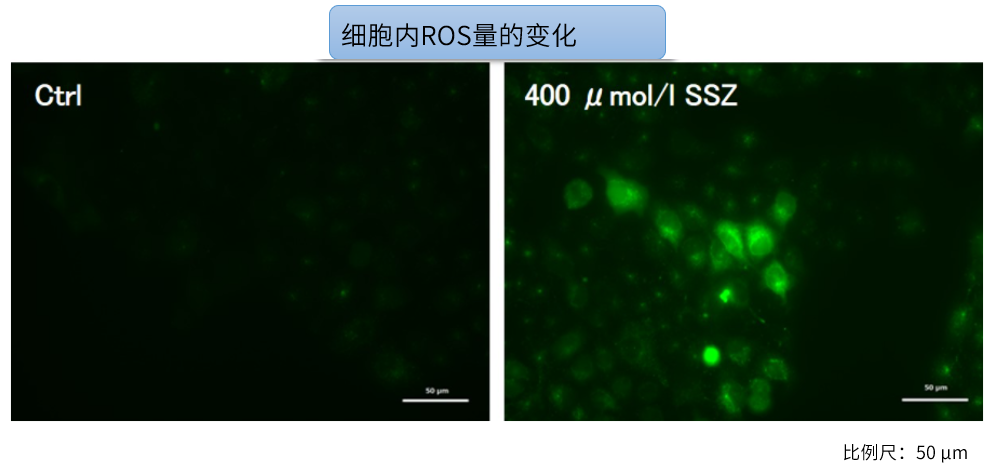
Sulfasalazine (SSZ) 引起的细胞内代谢变化实验例:
将已知会抑制胱氨酸/谷氨酸转运体(xCT)的Sulfasalazine(SSZ)加入到A549细胞后,确认谷氨酸释放量、细胞内ATP、α-酮戊二酸(α-KG)、谷胱甘肽(GSH)以及ROS的变化。
结果显示,SSZ加入后细胞内ATP、谷胱甘肽(GSH)和谷氨酸释放量减少,细胞内α-酮戊二酸和ROS增加。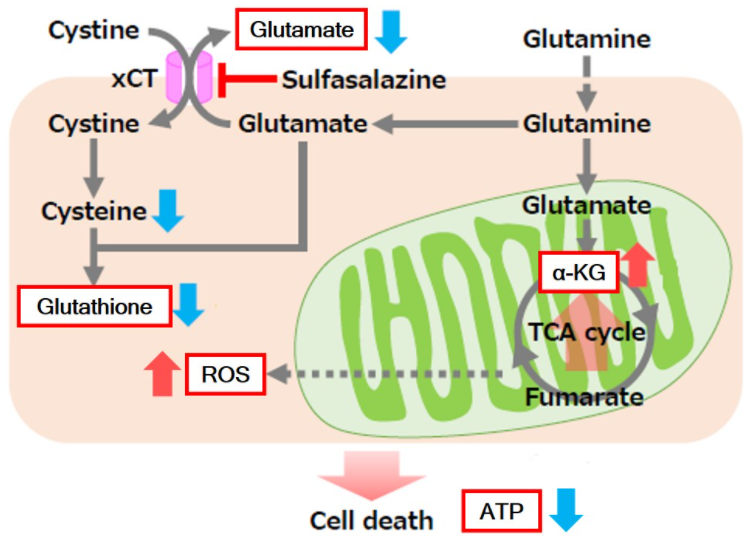
<使用产品>
· 细胞内GSH:GSSG/GSH Quantification Kit II(货号:G263)⬅电脑浏览点击品名(手机浏览点击此处)
· 细胞内ROS:ROS Assay Kit -Highly Sensitive DCFH-DA-(货号:R252)⬅电脑浏览点击品名(手机浏览点击此处)
· 细胞内ATP:ATP Assay Kit-Luminescence(货号:A550)
· 细胞内α-KG:α-Ketoglutarate Assay Kit-Fluorometric(货号:K261)
<实验条件>
细胞:A549细胞 (1 x 106 cells) 药物处理时间:48 h
参考文献) Shogo Okazaki et al.,”Glutaminolysis-related genes determine sensitivity to xCT-targeted therapy in head and neck squamous cell carcinoma”.Cancer Sci.,2019,doi:10.1111/cas.14182.
常见问题Q&A
| Q1:一个试剂盒可以检测样品的数量是多少? |
| A1:制备标准曲线和样品(n=3),可以检测的样品数量如下所示。
100 tests 样品数量(n=3) 24个样品(参照下图) 谷氨酸标准溶液和样品的96孔板排列示意图(n=3)
|
| Q2:配制后的Working solution可以保存多久? |
| A2:Working solution无法保存,需要现配现用。此外光会影响Working solution的稳定性,所以配制后请避光。
※Working solution配制后,避光室温条件下4 h稳定。当暴露于光线下,溶液的颜色会变成褐色。 |
| Q3:是否可以定量D-Glutamate? |
| A3:该试剂盒是用于L-Glutamate定量,无法定量D-Glutamate。 |
| Q4:是否可以检测含有还原性物质的样品? |
| A4:如果样品中含有还原性的物质,则WST染料也会发生显色,此时无法准确定量谷氨酸浓度。实验中如遇到以上情况,可以准备药物对照(不含细胞含药物的培养基+试剂)。 |
| Q5:待测样品可以保存吗? |
| A5:我们确认过细胞培养上清液样品可以-20°C保存1个月。
细胞裂解样品也可以-20°C保存1个月。 但是,在保存之前请使用试剂盒中的Filtration Tube进行脱蛋白处理。 |
| Q6:为什么我的样品孔没有显色? |
| A6:样品中的谷氨酸浓度可能低于检测限(5 µmol/l),谷氨酸浓度低于5 µmol/l的样品无法用该试剂盒检测。
如果待测样品被稀释,则稀释样品中含有的谷氨酸浓度可能低于5 µmol/l。请减少稀释比例,从而将检测样品的谷氨酸浓度调整到最低检测限以上。 |
| Q7:是否可以使用450 nm以外波长的滤光片进行检测? |
| A7:也可以使用490 nm的滤光片。但是,吸光度会低于在450nm处的吸光度。(见下图)
|
参考文献
1)Cobler,L.et al.,”xCT inhibition sensitizes tumors to γ-radiation via glutathione reduction”,Oncotarget,2018,9,32280-32297.
2)Tobias,M.et al.,”Role of GPX4 in ferroptosis and its pharmacological implication”,Free Radical Bioglogy and Medicine,2019,133,144-152.
3)K. Danchana, H. Iwasaki, K. Ochiai, H. Namba, T. Kaneta, “Determination of glutamate using paper-based microfluidic devices with colorimetric detection for food samples”, Microchem. J., 2022, doi:10.1016/j.microc.2022.107513.
4)Z. Xie, T. Kawasaki, H. Zhou, D. Okuzaki, N. Okada and M. Tachbana, “Targeting GGT1 Eliminates the Tumor-Promoting Effect and Enhanced Immunosuppressive Function of Myeloid-Derived Suppressor Cells Caused by G-CSF”, Front. Pharmacol., 2022, doi:10.3389/fphar.2022.873792.