第5回 使用人血预测大脑内小胶质细胞的活动性进行心理逆转录研究
小胶质细胞研究的前沿 —从基础到临床—
![]()
九州大学大学院 医学研究院 精神病医学 加藤隆弘
◆前言
近年有研究提出,在神经退行性疾病以及各种神经精神疾病中,免疫细胞小胶质细胞的参与对脑内炎症起着重要的作用,然而目前的发现还只是冰山一角。过去以小胶质细胞为目标的临床研究,其重点集中在死后的大脑研究和正电子发射型计算机断层显像(PET)研究。在这些研究中,主要报告了精神分裂症、抑郁症、自闭症谱系障碍和自杀患者大脑内小胶质细胞的过度活化。虽然利用PET技术可以对活体患者大脑内的部分小胶质细胞的活化进行测量,但实际上小胶质细胞活化的形式多样,而目前的PET技术能够检测到的活化种类只有TSPO这类占少数的活化形式。此外,关于分辨率也存在问题,仅使用PET,尤其是在分子水平上,评估动态且多样的小胶质细胞活化是非常困难的。特别是在新药开发方面,阐明分子基础是研究的关键,其局限性不容忽视。
理想的情况应当是采集并分析患者大脑中的小胶质细胞,但在伦理和技术层面上的难度太高。因此,分析从啮齿类等模型动物的大脑中采集的新鲜小胶质细胞,对于阐明小胶质细胞的病理而言必不可少,笔者的实验室也正在推进以小胶质细胞为重点的小鼠模型实验1)。然而,想要制备能够满足所有精神疾病表现型的模型动物是不可能的。为了打破这些局限,我们将在本文中介绍正在推进以人为对象,使用易于采集的血液进行精神疾病的逆转录研究内容。
◆人血来源iMG细胞的开发及应用
2016年以来,关于人iPS细胞来源小胶质样细胞开发的案例屡见报道,对于阐明小胶质细胞在各种脑疾病中的病理机制的期待也越来越高2,3)。尤其是在对遗传影响大的疾病中,分析iPS细胞来源小胶质样细胞十分有用,但在精神疾病中,相比遗传因子,更多的是环境因子造成的疾病,所以分析能够反映状况的疾病模型细胞显得非常重要。而笔者的实验室也一直在研发一种不使用重编程的iPS细胞,直接从体细胞中诱导小胶质样细胞的技术。
2014 年,通过向人外周血单核细胞添加GM-CSF和IL-34两种细胞因子,成功制备出只需两周即可完成的直接诱导小胶质(iMG)细胞(图 1)4)。
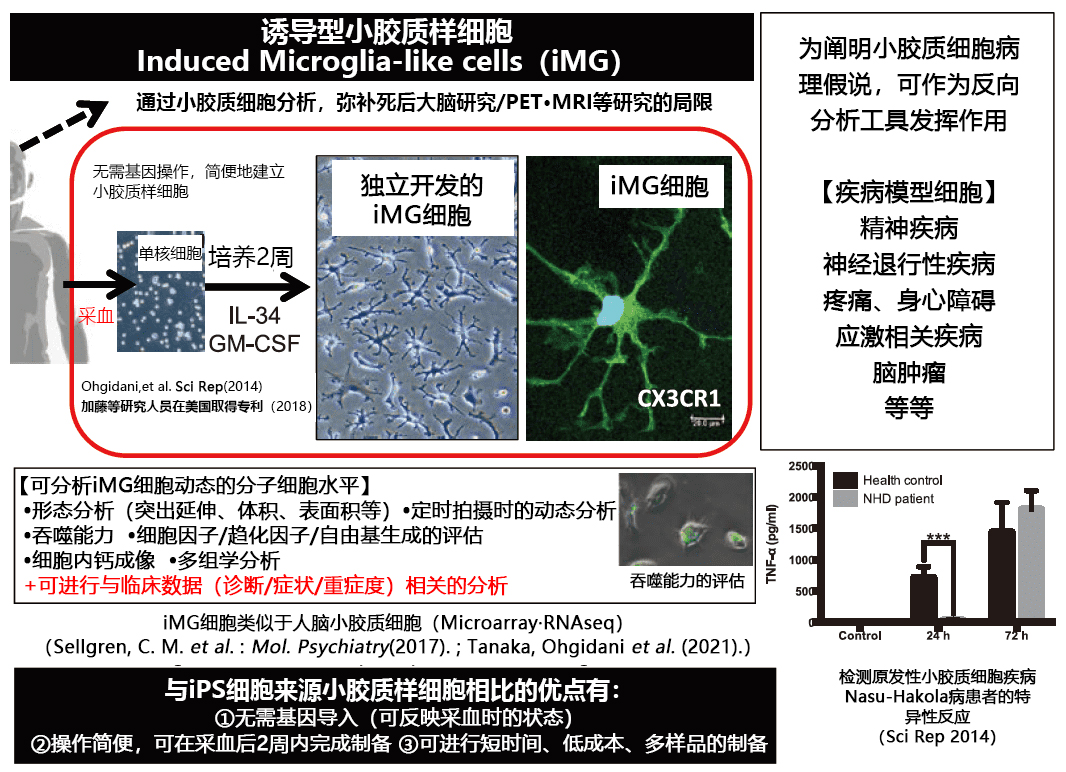
图1. 人血液来源直接诱导小胶质样(iMG)细胞的特征(转载改编自文献4和5)
与iPS细胞不同,iMG细胞无需一切基因重组的操作,只需通过化学诱导即可在短时间内制备获得,并能以相对较低的成本制备出大量的样品。此外,iMG细胞可以检测吞噬作用和细胞因子生成能力等动态功能,并且可以分析活细胞的各种分子水平,有望弥补死后大脑研究和PET研究的不足4,5)。
在2014 年开发时,发现iMG细胞具有人脑小胶质细胞的许多特性,并显示与单核细胞和巨噬细胞不同的表现型4)。美国马萨诸塞州综合医院(MGH)的研究小组根据笔者团队的建议,通过微阵列分析发现所制备的iMG细胞与人脑小胶质细胞最为相似6)。笔者团队通过和九州大学脑外科合作,使用RNAseq进行全面的基因表达分析,发现了外周血来源的iMG细胞与同一患者相同时期的大脑小胶质细胞类似(Tanaka, S. et al. : Frot. Immunol., in press)。
人iMG细胞已经应用于神经精神疾病和疼痛性疾病的病理阐明研究和生物标记开发研究。笔者团队首先着眼于代表性的原发性小胶质细胞疾病Nasu-Hakola病(NHD)。从一名30多岁时出现精神症状、40多岁时痴呆症状恶化并处于长期卧床状态的女性患者中制备的iMG细胞中发现,对于吞噬刺激,TNF-α和IL-6等炎症细胞因子的生成的应答具有延迟倾向,同时还发现了IL-10等保护性细胞因子的生成往往从早期阶段开始就被抑制4)。这些患者来源iMG细胞的反应,表明了由小胶质细胞引起的慢性脑内炎症参与了Nasu-Hakola病等多种精神症状的出现和青年性痴呆的发病4)。
接着,当笔者在进行临床相关的双相情感障碍I型和快速循环型(Rapid cycler)患者的iMG细胞分析时,发现1名男性患者在躁狂状态下显示的mRNA分析为M1型显性;与佐贺大学精神科合作,并尝试对3名患者进行分析时,发现作为M2型代表性标记的甘露糖受体CD206,其mRNA表达处于“抑郁状态”时,同时表现亢进7)。这些结果表明,小胶质细胞免疫应答的变化可能在双相情感障碍的“躁狂”和“抑郁”的转变过程中起重要作用7)。
此外,我们还与九州大学心理科合作,使用不单是精神疾病患者,更针对身体疾病患者的iMG细胞进行了逆转录研究5),在女性纤维肌痛患者的iMG细胞中,发现了TNF-α mRNA的高表达,我们提出其可能会成为疼痛性疾病的客观性生物标记8)。在与九州大学脑外科合作时,我们还发现iMG细胞CD206的表达模式可能是可以预测脑肿瘤(神经胶质瘤)进展的标记(Tanaka, S. et al. : Front. Immunol., in press)。
iMG细胞已经在国外的研究机构中得到灵活应用。上述的MGH团队通过对精神分裂症患者血液来源的iMG细胞和同一患者iPS细胞来源的神经元进行共培养实验,发现在精神分裂症患者中,活化的小胶质细胞对补体介导的神经突触损伤非常重要,据报道称,通过使用对小胶质细胞活化具有抑制作用的抗菌剂米诺环素,可以挽救神经突触损伤9)。美国和荷兰等国际合作研究团队也开始使用精神分裂症患者来源的iMG细胞进行研究,据报道称,患者来源的iMG细胞对LPS反应更为灵敏,可产生更多的TNF-α10)。
◆人血代谢组学分析
在笔者的实验室中,不仅研究血细胞成分,还从血浆和血清中寻找线索,以了解大脑中小胶质细胞的动态。例如,在使用血浆进行神经来源外泌体相关的分析中,发现小胶质细胞活性所必需的细胞因子IL-34可能与抑郁症的病理相关11)。另外,在与九州大学检查部合作期间,从呈现抑郁的患者中采集外周血进行代谢组学分析时,发现了部分与抑郁症严重程度相关的血液代谢物,并且还发现了自杀意愿的强烈程度与小胶质细胞活化密切相关的色氨酸-犬尿氨酸代谢途径中的多种代谢物相关12,13)。
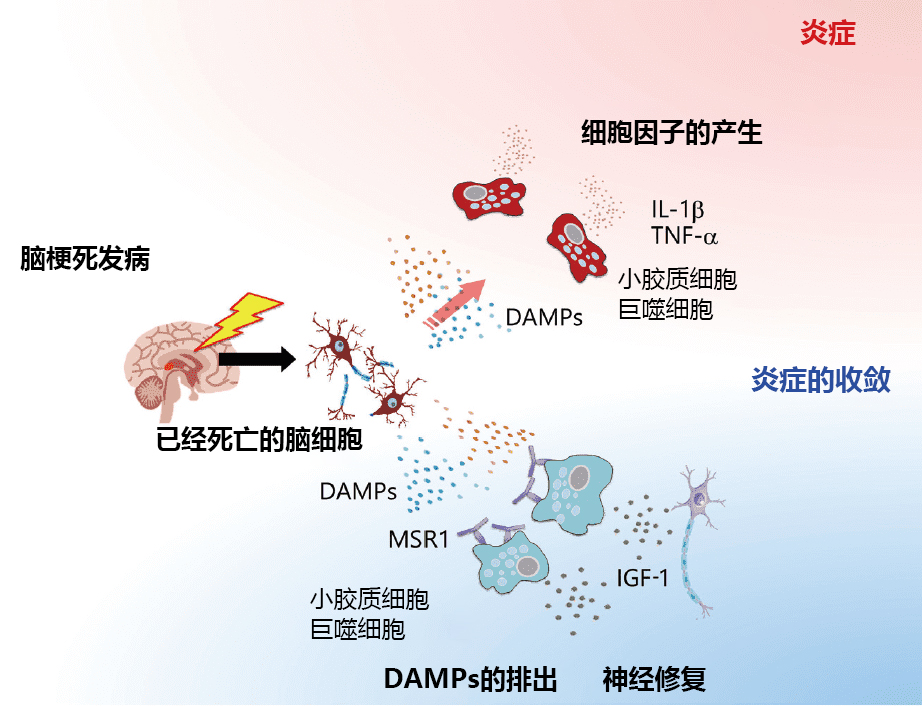
这些结果支撑了死后大脑研究中自杀患者大脑内小胶质细胞活化的报告内容。假设的控制和掌握小胶质细胞的活化有助于应对自杀这一紧迫的社会问题,我们目前正在结合各种方法来推进双方向性研究14)(图2)。

图2. 阐明精神疾病的病理和开发生物标记的多轴方法
(例:自杀相关行为的对策),参考文献14的引用·改编
◆结语
小胶质细胞的过度活化和活化控制不足可能与抑郁、不安、妄想以及产生自杀念头等精神症状或精神病理相关。今后,我们将继续以各种精神疾病为对象获取临床数据,进行人体血液分析(iMG细胞分析和代谢组学分析)以及推进结合人脑分析的逆转录研究,通过阐明分子细胞水平上小胶质细胞介导的精神病理学机制,有望开发出以小胶质细胞为靶向的新型治疗药。通过采血制备iMG细胞的分析和代谢组学分析,有望用作能够反映不止在精神疾病上,更能对在各种疾病中大脑小胶质细胞动态的客观性生物标记。
本系列在九州大学大学院药学研究院 药理学领域 津田 诚 老师的协助下策划并撰写。
◆参考文献
1. Ohgidani, M. et al. : Brain Behav. Immun., 55, 17-24 (2016).
2. Muffat, J. et al. : Nat. Med., 22, 1358-1367 (2016).
3. Pocock, J. M. and Piers, T. M. : Nat. Rev. Neurosci., 19, 445-452 (2018).
4. Ohgidani, M. et al. : Sci. Rep. , 4, 4957 (2014).
5. Ohgidani, M. et al. : Front. Cell. Neurosci., 9, 184 (2015).
6. Sellgren, C. M. et al. : Mol. Psychiatry., 22, 170-177 (2017).
7. Ohgidani, M. et al. : Front. Immunol., 7, 676 (2017).
8. Ohgidani, M. et al . ; Sci. Rep. , 7, 11882 (2017).
9. Sellgren, C. M. et al. : Nat. Neurosci., 22, 374-385 (2019).
10. Ormel, P. R. et al. : Brain Behav. Immun., 90, 196-207 (2020).
11. Kuwano, N. et al. : J. Aff ect. Disord., 240, 88- 98 (2018).
12. Kuwano, N. et al. : J. Aff ect. Disord., 231, 74- 82 (2018).
13. Setoyama, D. et al. : PLoS One, 11, e0165267 (2016).
14. Suzuki, H. et al. : Front. Cell. Neurosci., 13, 31 (2019).
◆小胶质细胞研究用Iba1抗体系列
|
产品编号 |
产品名称 |
来源 |
交叉反应 |
应用 |
规格 |
|
016-20001 |
Anti Iba1,Rabbit (for Western Blotting) |
兔 |
小鼠,大鼠,人 |
WB |
50 μg |
|
019-19741 |
Anti Iba1, Rabbit (for Immunocytochemistry) |
兔 |
小鼠,大鼠,人 |
ICH(F) |
50 μg |
|
013-27691 |
Anti Iba1, Rabbit(for Paraffin Section) |
兔 |
小鼠,大鼠 |
ICH(P) |
50 μg |
|
012-26723 |
Anti Iba1, Monoclonal Antibody(NCNP24) |
小鼠 |
小鼠(仅DAB),大鼠,狨猴 |
ICH(F) |
10 μL |
|
016-26721 |
Anti Iba1, Monoclonal Antibody(NCNP24) |
小鼠 |
小鼠(仅DAB),大鼠,狨猴 |
ICH(F) |
50 μL |
|
013-27593 |
Anti Human Iba1, Monoclonal Antibody(NCNP27) |
小鼠 |
人 |
ICH(P) |
50 μL |
|
017-27591 |
Anti Human Iba1, Monoclonal Antibody(NCNP27) |
小鼠 |
人 |
ICH(P) |
10 μL |
|
011-27991 |
Anti Iba1, Goat |
山羊 |
小鼠,大鼠 |
ICH(F) |
100 μL |
|
016-26461 |
Anti Iba1, Rabbit, Biotin-conjugated |
兔 |
小鼠,大鼠 |
ICH(F) |
100 μL |
|
013-26471 |
Anti Iba1, Rabbit, Red Fluorochrome(635)-conjugated |
兔 |
小鼠,大鼠 |
ICH(F) |
100 μL |
|
015-28011 |
Anti Iba1, Rabbit, SPICA Dye™ 568-conjugated |
兔 |
小鼠,大鼠 |
ICH(F) |
100 μL |
※以上所有产品仅供实验研究用,不可用于人体,不可用作医药品、食品、临床诊断等。