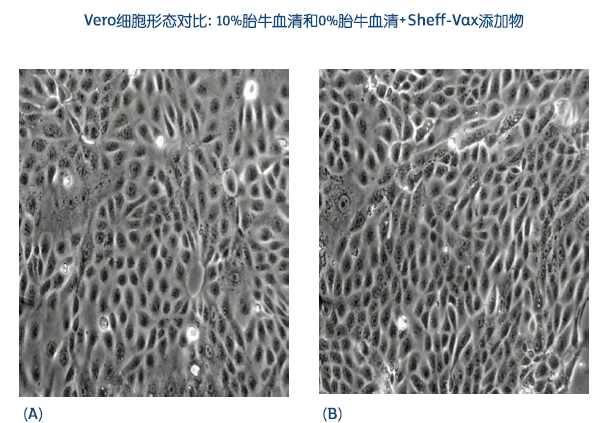
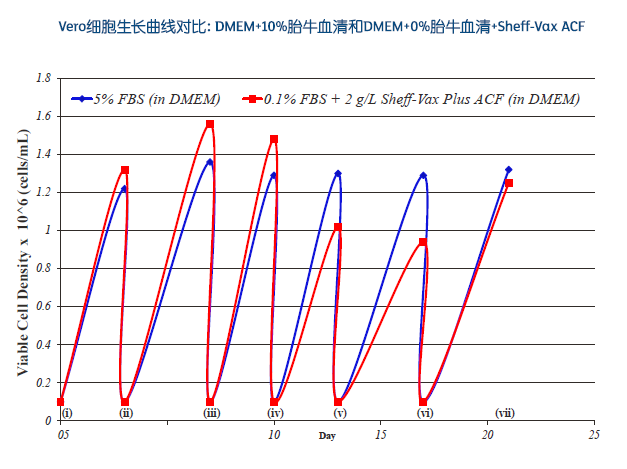
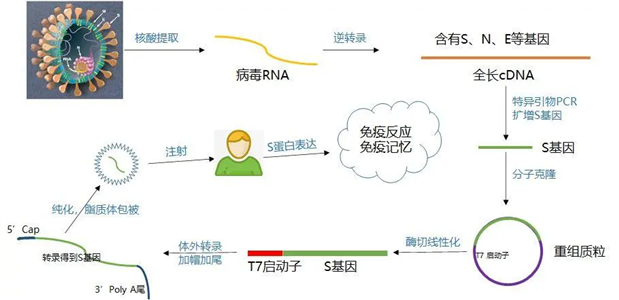
mRNA 疫苗的未来
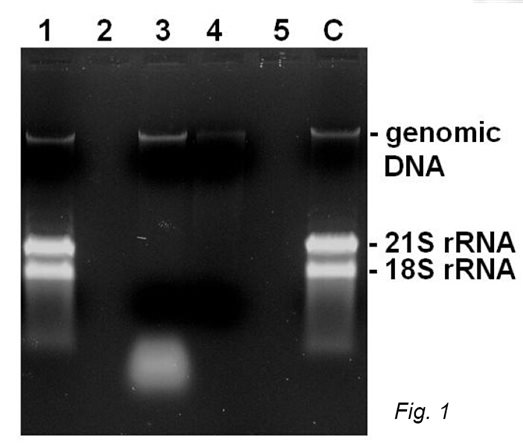
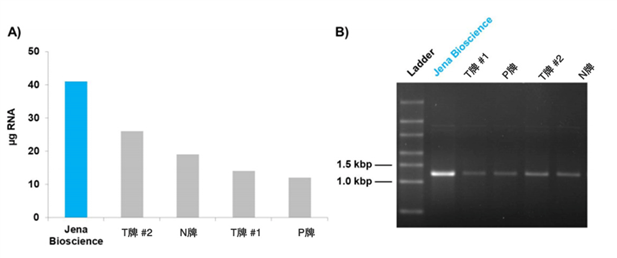
亲和纯化(也称为亲和层析)被认为是纯化层析或从复杂混合物(例如粗制细胞裂解物、细胞培养上清液或其他样品)中富集感兴趣蛋白质的强大方法。
信使 RNA (mRNA) 技术可用于发现其他传染病的新药和治疗方法。
在COVID 19大流行出现之前,大多数公众甚至没有听说过信使RNA,更不用说它在疾病治疗和预防方面的巨大潜力了。尽管过去25年来对mRNA的可能应用进行了广泛的研究和实验室实验,但一些人认为COVID 19疫苗的开发过于仓促,因此缺乏可信度。有些人甚至认为它弊大于利。然而,针对致命的 COVID 19 大流行的 mRNA 疫苗的成功证明反对者是错误的。这种新颖的接种方法永远改变了疫苗行业的未来,并为对抗其他传染病和未来流行病开辟了一个充满机遇的全新世界。
与传统疫苗相比的优势
与传统疫苗相比,使用 mRNA 技术生产的疫苗具有多种优势。具体来说,它们更安全、更有效、更容易适应,并且需要更少的生产时间和成本。
安全。传统疫苗使用灭活病毒来引发免疫反应,而 mRNA 疫苗不包含完整的微生物(无论是死的还是活的),并且不会造成感染或 DNA 整合的风险。然而,在免疫接种后的几天内可能会出现轻微和暂时的副作用(例如肌肉疼痛、注射部位肿胀和流感样症状)。
功效。最近的进展是为了规避 mRNA 技术的局限性。具体来说,mRNA 分子被包装在脂质中,以提高稳定性、细胞递送效率和免疫反应。
适应性。 mRNA 可以根据需要进行开发和调整,使其能够轻松适应不同的病原体。由于只需要目标蛋白的遗传密码,因此实际上可以在几天内生成合成 mRNA 。值得注意的是,COVID 19 疫苗接种的主要延误与生产、测试和监管审批有关。
成本效益。与其他平台相比,mRNA疫苗更具成本效益,随着未来的进步,生产成本有望进一步降低。
未来该何去何从?
毫不奇怪,鉴于 mRNA 疫苗在对抗 COVID 19 方面取得了惊人的成功,科学家们决心进一步开发该技术。一些公司正在研究在较高温度下更稳定的疫苗配方,而另一些公司正在试验单剂第二代疫苗。可有效对抗未来可能出现的病毒株的通用 COVID 19 疫苗也在研发中。
针对以下情况开发 mRNA 疫苗,仅举几例:
-
流感
-
艾滋病病毒
-
寨卡病毒
-
黄热病
-
结核
-
乙型肝炎
-
囊性纤维化
-
狂犬病
-
癌症
BioNTech 和辉瑞正在合作开发一种针对季节性流感病毒的通用 mRNA 疫苗,而 Moderna 目前正在进行呼吸道合胞病毒 (RSV) mRNA 疫苗的一期临床试验。与此同时,该公司正在招募 CMV 疫苗的 3 期临床试验人员。
CureVac 的 mRNA 狂犬病疫苗正处于一期临床试验,而 mRNA HIV 疫苗目前正处于临床前试验的早期阶段。
BioNTEch 和 Moderna 还在测试几种 mRNA 癌症疗法和针对多种癌症的个性化治疗,包括黑色素瘤、结直肠癌和头颈癌。
鉴于 mRNA 疫苗只需要特定蛋白质的一段遗传密码即可刺激免疫反应,因此它可以用于针对任何现有的病原体。事实上,mRNA 技术的可能性和潜力几乎是无限的。