chempep氨基酸概述
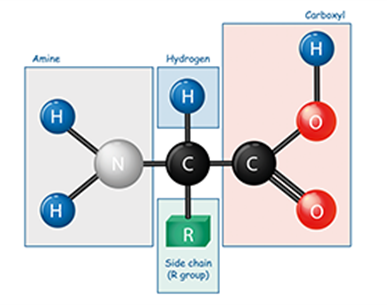
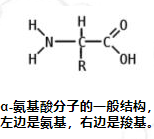
在化学中,氨基酸是同时含有胺和羧基官能团的分子。在生物化学中,该术语指通式为 NH2CHRCOOH 的 α-氨基酸。 [1]这些分子的氨基和羧酸根连接在同一个碳上,称为 α-碳。各种α氨基酸的不同之处在于其α碳上连接的侧链(R基团)。它的大小可以变化,从甘氨酸中的氢原子到丙氨酸中的甲基,再到色氨酸中的大杂环基团。
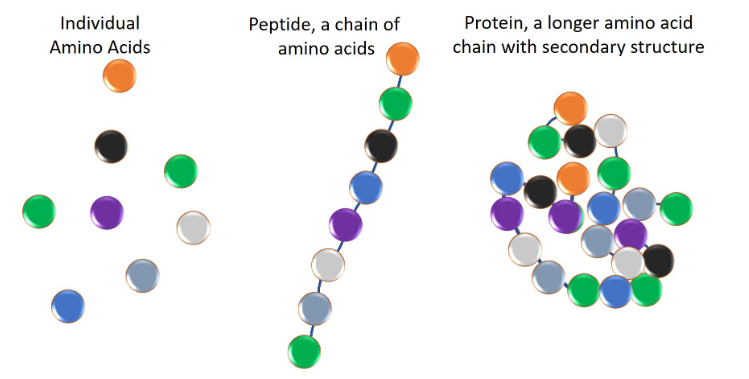
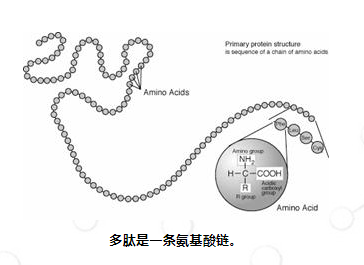
α-氨基酸是蛋白质的组成部分。蛋白质通过氨基酸缩合形成通过肽键连接的氨基酸“残基”链。每种不同的蛋白质都有氨基酸残基序列;该序列是蛋白质的一级结构。氨基酸也可以以不同的序列连接起来形成各种各样的蛋白质。
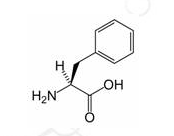
苯丙氨酸是标准氨基酸之一。
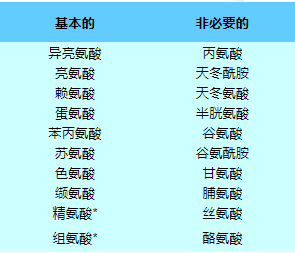
细胞在蛋白质生物合成中使用二十种标准氨基酸,这些氨基酸由通用遗传密码决定。这二十种氨基酸是由其他分子生物合成的,但生物体的不同之处在于它们可以合成哪些氨基酸以及必须在饮食中提供哪些氨基酸。生物体不能合成的氨基酸称为必需氨基酸。
氨基酸是蛋白质的基本结构单元。它们形成称为肽的短聚合物链或称为多肽或蛋白质的较长链。这种从 mRNA 模板形成的过程称为翻译,是蛋白质生物合成的一部分。二十种氨基酸由标准遗传密码编码,称为蛋白氨基酸或标准氨基酸。蛋白质中含有的其他氨基酸通常是通过翻译后修饰形成的,即蛋白质合成中翻译后的修饰。这些修饰对于蛋白质的功能或调节通常是必需的;例如,谷氨酸的羧化可以更好地结合钙阳离子,脯氨酸的羟基化对于维持结缔组织和应对缺氧至关重要。此类修饰还可以确定蛋白质的定位,例如,添加长疏水基团可以导致蛋白质与磷脂膜结合。
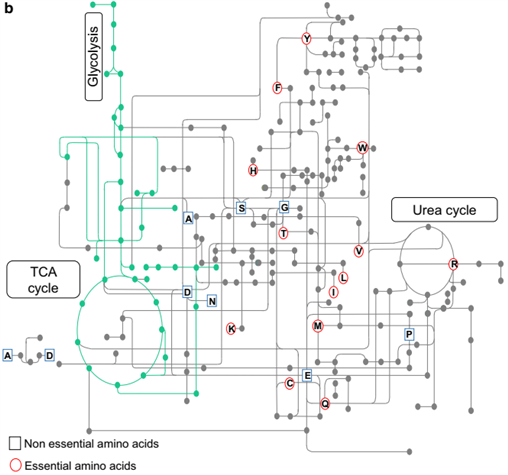
二十种标准氨基酸要么用于合成蛋白质和其他生物分子,要么氧化成尿素和二氧化碳作为能量来源。 [2]氧化途径从转氨酶去除氨基开始,然后氨基进入尿素循环。转酰胺基化的另一种产物是进入柠檬酸循环的酮酸。 [3]生糖氨基酸也可以通过糖异生转化为葡萄糖。[4]
自然界中已发现数百种非蛋白质氨基酸,它们在生物体中具有多种功能。微生物和植物可以产生不常见的氨基酸。在微生物中,例子包括 2-氨基异丁酸和羊毛硫氨酸,羊毛硫氨酸是一种硫桥丙氨酸二聚体。这两种氨基酸都存在于肽类羊毛硫抗生素中,例如阿拉甲星。 [5]而在植物中,1-氨基环丙烷-1-羧酸是一种小的双取代环状氨基酸,是生产植物激素乙烯的关键中间体。 [6]
在人类中,非蛋白质氨基酸也具有重要的生物学作用。甘氨酸、γ-氨基丁酸和谷氨酸是神经递质,许多氨基酸用于合成其他分子,例如:
• 色氨酸是神经递质血清素的前体
• 甘氨酸是血红素等卟啉的前体
• 精氨酸是一氧化氮激素的前体
• 肉碱用于细胞内的脂质运输,
• 鸟氨酸和 S-腺苷甲硫氨酸是多胺的前体,
• 同型半胱氨酸是 S-腺苷甲硫氨酸回收的中间体
还存在羟脯氨酸、羟赖氨酸和肌氨酸。甲状腺激素也是α-氨基酸。
甚至在陨石中也检测到了一些氨基酸,特别是在一种称为碳质球粒陨石的陨石中。 [7]这一观察结果促使人们提出生命可能是从外星来源到达地球的。
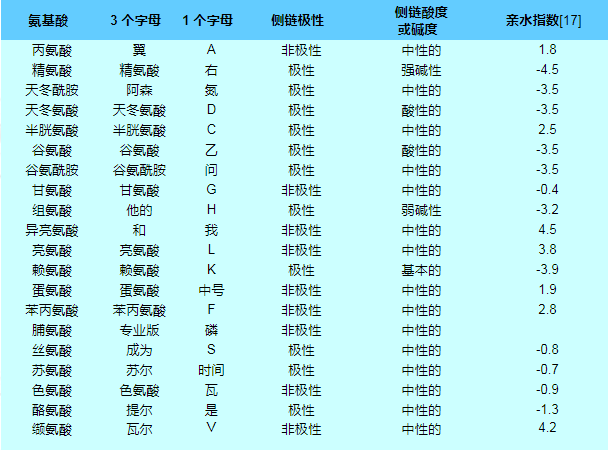
在下面所示的结构中,R表示各氨基酸侧链。称为 Cα 的中心碳原子是手性中心碳原子(甘氨酸除外),两个末端和 R 基团连接在其上。氨基酸通常根据侧链的性质分为四组。侧链可以使它们表现得像弱酸、弱碱、亲水性(如果它们是极性的)和疏水性(如果它们是非极性的)。标准氨基酸列表中列出了 20 种标准氨基酸的化学结构及其化学性质。
短语“支链氨基酸”或BCAA有时用于指具有非线性脂肪族侧链的氨基酸;它们是亮氨酸、异亮氨酸和缬氨酸。脯氨酸是侧基与α-氨基连接的蛋白质氨基酸,因此也是在该位置含有仲胺的蛋白质氨基酸。脯氨酸有时被称为亚氨基酸,但这在当前的命名法中是不正确的
异构
大多数氨基酸可以存在两种旋光异构体,即 D 型和 L 型。L-氨基酸代表了蛋白质中发现的绝大多数氨基酸。 D-氨基酸存在于外来海洋生物(如锥蜗牛)产生的一些蛋白质中。[9]它们也是细菌肽聚糖细胞壁的丰富成分。 [10]
氨基酸构型的L和D约定不是指旋光活性,而是指与氨基酸具有相同立体化学的甘油醛异构体的旋光活性。 S-甘油醛是左旋的,R-甘油醛是右旋的,因此S-氨基酸即使不是左旋的也被称为L-,而R-氨基酸即使不是右旋的也同样被称为D-。
这些氨基酸异构现象的一般规则有两个例外。首先,甘氨酸,其中 R = H,不可能存在异构现象,因为 α-碳带有两个相同的基团(氢)。其次,在半胱氨酸中,L = S 和 D = R 的分配颠倒为 L = R 和 D = S。半胱氨酸的结构与其他氨基酸类似(相对于甘油醛),但硫原子改变了 Cahn 的解释-Ingold-Prelog优先规则。
反应
由于氨基酸同时具有伯胺基和伯羧基,因此这些化学物质可以经历与这些官能团相关的大部分反应。这些包括胺基团的亲核加成、酰胺键形成和亚胺形成以及羧酸基团的酯化、酰胺键形成和脱羧。氨基酸的多个侧链也可以发生化学反应。这些反应的类型由这些侧链上的基团决定,并在涉及每种特定类型氨基酸的文章中进行了讨论。
肽键形成
由于氨基酸的胺基和羧酸基团都可以反应形成酰胺键,因此一个氨基酸分子可以与另一个氨基酸分子反应并通过酰胺键连接。氨基酸的聚合作用产生了蛋白质。该缩合反应产生新形成的肽键和水分子。在细胞中,该反应不会直接发生,而是通过酯键连接至转移 RNA 分子来激活氨基酸。这种氨酰 tRNA 是在氨酰 tRNA 合成酶进行的 ATP 依赖性反应中产生的。然后,该氨酰基-tRNA 成为核糖体的底物,核糖体催化延长蛋白链的氨基对酯键的攻击。 由于这种机制,所有蛋白质都是从 N 端开始合成,并向 C 端移动。
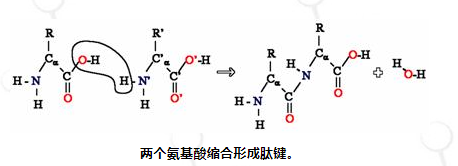
然而,并非所有肽键都是以这种方式形成的。在少数情况下,肽是由特定的酶合成的。例如,三肽谷胱甘肽是细胞防御氧化应激的重要组成部分。该肽是由游离氨基酸分两步合成的。[13]在第一步中,γ-谷氨酰半胱氨酸合成酶通过谷氨酸的侧链羧基(该侧链的γ碳)和半胱氨酸的氨基之间形成的肽键缩合半胱氨酸和谷氨酸。然后,这种二肽通过谷胱甘肽合成酶与甘氨酸缩合,形成谷胱甘肽。
在化学中,肽是通过多种反应合成的。固相肽合成中常用的一种,它使用氨基酸的芳香族肟衍生物作为活化单元。这些按顺序添加到不断增长的肽链上,肽链附着在固体树脂支持物上。
由于氨基酸同时具有胺和羧酸的活性基团,因此它们可以被视为酸和碱(尽管它们的天然 pH 值通常受 R 基团的影响)。在称为等电点的特定 pH 值下,胺基团获得正电荷(质子化),酸基团获得负电荷(去质子化)。确切的值因每种不同的氨基酸而异。这种离子被称为两性离子。由于其偶极性质,两性离子可以作为具有非常高熔点的白色晶体结构从溶液中提取。接近中性的生理 pH 值允许大多数游离氨基酸以两性离子形式存在。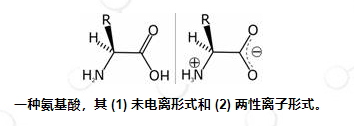
亲水性和疏水性氨基酸
根据侧链的极性,氨基酸的亲水性或疏水性特征有所不同。这些特性对于蛋白质结构和蛋白质-蛋白质相互作用很重要。侧链物理特性的重要性来自于它对氨基酸残基与其他结构相互作用的影响,无论是在单个蛋白质内还是在蛋白质之间。亲水性和疏水性氨基酸的分布决定了蛋白质的三级结构,它们在蛋白质外部结构上的物理位置影响其四级结构。例如,可溶性蛋白质的表面富含丝氨酸和苏氨酸等极性氨基酸,而整合膜蛋白往往具有疏水性氨基酸的外环,将其锚定到脂质双层中,并且锚定到膜上的蛋白质具有锁定到膜中的疏水端。同样,必须与带正电的分子结合的蛋白质的表面富含带负电的氨基酸,如谷氨酸和天冬氨酸,而与带负电的分子结合的蛋白质的表面富含赖氨酸和精氨酸等带正电的链。最近提出了一种基于疏水缔合自由能的新疏水性尺度[16]。必须与带正电的分子结合的蛋白质的表面富含带负电的氨基酸,如谷氨酸和天冬氨酸,而与带负电的分子结合的蛋白质的表面富含赖氨酸和精氨酸等带正电的链。最近提出了一种基于疏水缔合自由能的新疏水性尺度[16]。必须与带正电的分子结合的蛋白质的表面富含带负电的氨基酸,如谷氨酸和天冬氨酸,而与带负电的分子结合的蛋白质的表面富含赖氨酸和精氨酸等带正电的链。最近提出了一种基于疏水缔合自由能的新疏水性尺度[16]。
蛋白质的亲水和疏水相互作用不必仅依赖于氨基酸本身的侧链。通过各种翻译后修饰,其他链可以附着到蛋白质上,形成疏水性脂蛋白或亲水性糖蛋白。
标准氨基酸缩写及侧链性质表
除了正常的氨基酸代码之外,使用占位符来应对肽或蛋白质的化学或晶体学分析无法确定结构中某个残基的身份。他们无法解析的是这些氨基酸对:
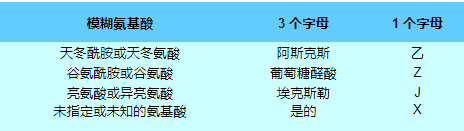
Unk 有时用来代替 Xaa,但不太标准。
非标准氨基酸
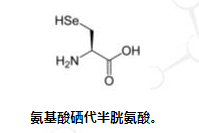
除了二十种标准氨基酸和两种特殊氨基酸外,还有大量的“非标准氨基酸”。其中两种可以在遗传密码中编码,但在蛋白质中相当罕见。硒代半胱氨酸在 UGA 密码子处掺入某些蛋白质中,该密码子通常是终止密码子。 [18]一些产甲烷细菌将吡咯赖氨酸用于产生甲烷的酶中。它是用密码子 UAG 编码的。
蛋白质中未发现的非标准氨基酸的例子包括羊毛硫氨酸、2-氨基异丁酸、脱氢丙氨酸和神经递质γ-氨基丁酸。非标准氨基酸通常作为标准氨基酸代谢途径的中间体出现 – 例如鸟氨酸和瓜氨酸出现在尿素循环中,是氨基酸分解代谢的一部分。 [20]
非标准氨基酸通常是通过对标准氨基酸进行修饰而形成的。例如,同型半胱氨酸是通过半胱氨酸的转硫途径形成的,或作为S-腺苷甲硫氨酸代谢的中间体,[21],而多巴胺是由酪氨酸合成的,羟脯氨酸是通过脯氨酸的翻译后修饰产生的。
技术用途
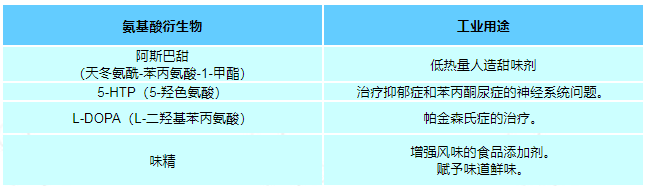
在20种标准蛋白氨基酸中,有10种被称为必需氨基酸,因为人体无法通过化学反应从其他化合物合成它们,因此必须从食物中获取。半胱氨酸、酪氨酸、组氨酸和精氨酸被认为是儿童的半必需氨基酸,因为合成这些氨基酸的代谢途径尚未发育。