上海金畔社生物科技有限公司日本同仁化学dojindo全线产品代理 中国代理商
特点:
● 荧光素标记的产品可以在大约2小时内制备。
● 可以标记分子量为50,000或更高的蛋白质。
● 可以标记50至200μg的蛋白质。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● 荧光素标记的物体可以与所附的存储溶液一起存储。

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Biotin Labeling Kit – NH2 生物素抗体标记试剂盒-氨基
NO.2. Peroxidase Labeling Kit – NH2 过氧化物酶标记试剂盒-氨基
NO.3. Cell Counting Kit-8 细胞增殖毒性检测
NO.4. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.5. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
试剂盒内含

产品概述
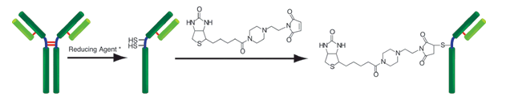
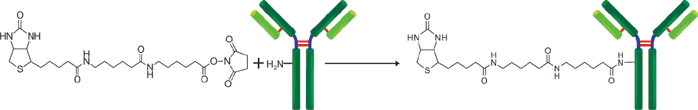
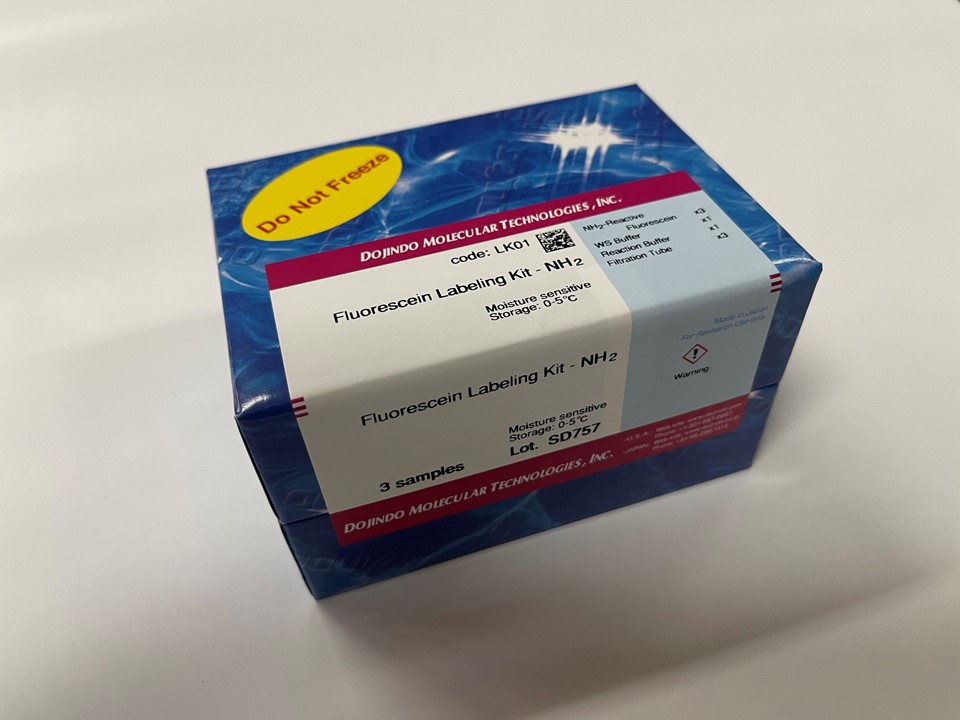
该试剂盒主要用于制备用荧光素标记的蛋白质,如免疫转染中的IgG和胞内蛋白示踪。氨基反应型荧光素是试剂盒的成分之一,它含有琥珀酰亚胺基(NHS),能与蛋白质或者其它分子的氨基反应。该试剂盒中包含了标记所需的全部试剂,包括Storage buffer。每一管荧光素最多能够标记200μg的IgG,每个IgG分子可与4-6个荧光素分子共价结合。该试剂盒还包含一个缓冲液交换系统,因此含有氨基缓冲液的样品也能用此试剂盒来标记。虽然用膜来过滤有时会导致IgG聚集,但是试剂盒中的缓冲液交换系统能够防止标记过程中聚集现象的发生。用该试剂盒标记的抗体在4℃下能够保存至少2个月。被荧光素标记后的IgG的激发和发射波长分别为495nm和520nm。
原理
产品优势
1)荧光素标记的产品可以在大约2小时内制备。
2)可以标记分子量为50,000或更高的蛋白质。
3)可以标记50至200μg的蛋白质。
4)可以通过使用过滤管的分离操作以高回收率获得标记物质。
5)荧光素标记的物体可以与所附的存储溶液一起存储。
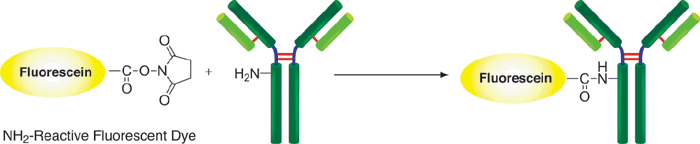
荧光特性
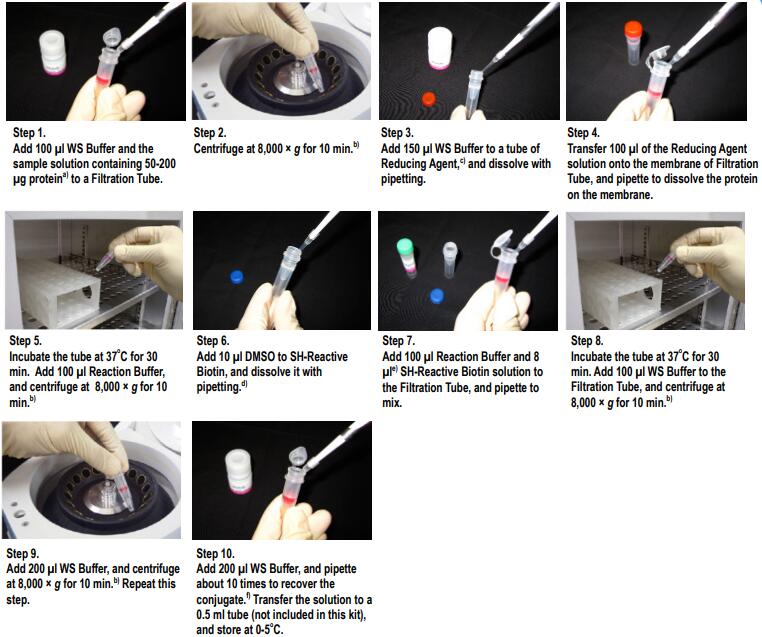
操作步骤
使用注意事项:
1. 用该试剂盒标记的蛋白质的分子量要>50,000。
2. 在标记过程中,IgG或者Fluorescein -IgG标记物始终存在于Filtration tube的滤膜上。
3. 如果IgG溶液中含有分子量>10,000的其他蛋白质,如BSA或明胶时,在使用该试剂盒标记前,先要纯化IgG溶液。IgG溶液能够用IgG Purification Kits(不包含于本试剂盒 中)来纯化。
4. 如果IgG溶液含有小的不溶物,离心后取上清液来进行标记。
5. 如果长时间不使用,建议您把试剂盒中的标记试剂NH2-reactive fluorescein放在-20℃冰箱中保存,不需要充氮气,可以更好地保持标记试剂的活性,但请不要把其它试剂和过滤管放到-20℃冰箱中,仍请放在0-5℃冰箱中保存。

a) 样品溶液的体积不应超过100μl。如果抗体浓度低于1mg/ml,重复步骤1和2直至总的IgG聚积量达到100 μg。如果聚积过程中滤液的体积超过400μl,则在进行后续的离心操作前应除去滤液。
b) 如果溶液在离心后仍然残留在膜上,可以再离心5 min或者适当增加转速直至膜上没有残留液体。
c) NH2-Reactive Fluorescein Dye在管子的底部,向管底加入10μl DMSO,吹打数次使其溶解,如果没有DMSO的话,可以用乙醇来替代。
d) 如果IgG的量为200μg,在步骤4时加入所有的NH2-Reactive Fluorescein Dye溶液。
e) 并不一定要使用WS Buffer来回收标记产物,可以选择任何适合于该实验的缓冲液来替代。
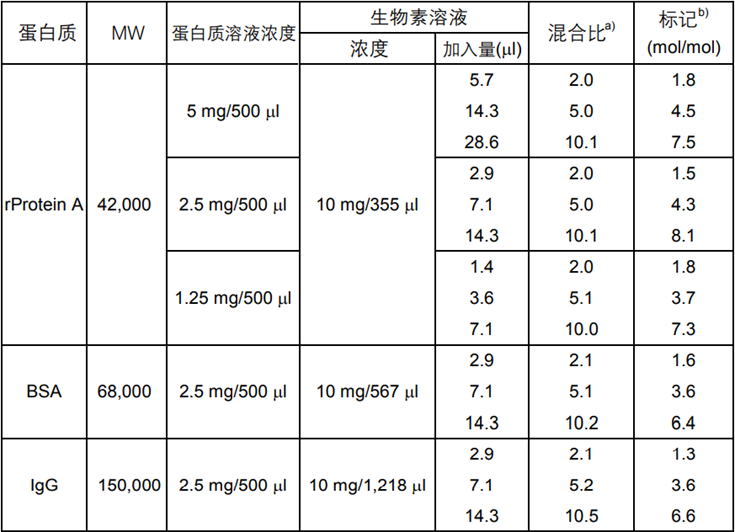
标记率计算
计算标记率:
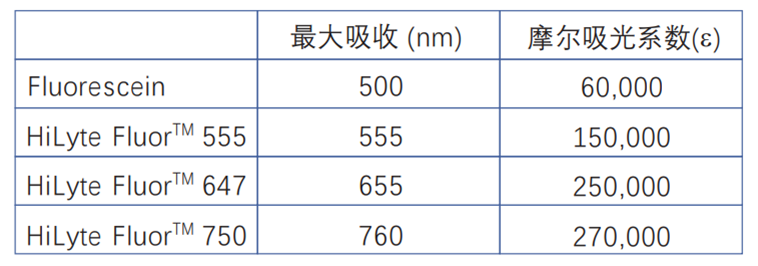
1分子蛋白质上结合的荧光素的数量 (标记率) 的计算方法:将标记的蛋白质溶液用5倍的中性缓冲液稀释,分别测定在280nm和各个荧光染料的最大吸收波长处的吸光度,采用以下公式计算。
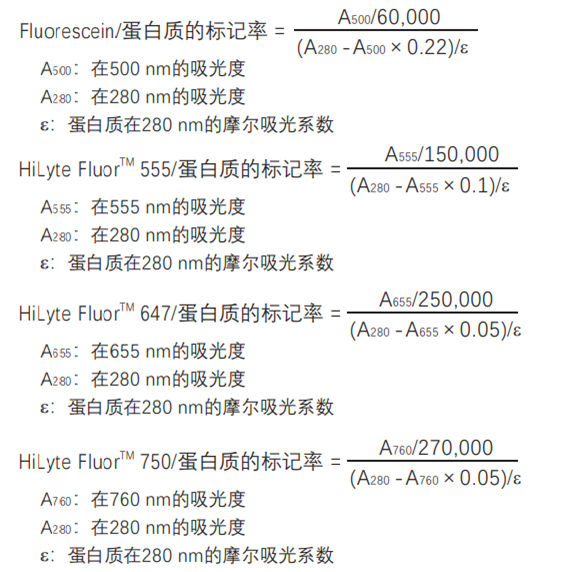
* 如果是IgG,摩尔吸光系数ε=216,000。
* 荧光染料在WS缓冲液中的摩尔吸光系数参见下表:
常见问题Q&A
| Q1:能够用这个试剂盒标记其他蛋白质吗? |
| A:可以。只要标记分子的分子量>50,000。 |
| Q2:标记蛋白之前是否必须使用过滤管? |
| A:如果蛋白溶液中不含有带有活性氨基的小分子且蛋白浓度在10mg/ml或者70μM左右时,可以不使用过滤管来过滤,只需要将10μl 样品溶液和90μl Reaction Buffer以及8μl NH2-reactive Fluorescein(由步骤3所得)混合并按照操作说明上的方法做从步骤4开始的后续试验。 |
| Q3:能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
| A:不行。寡核苷酸或者寡肽可能因为分子量太小而不能存在于滤膜上。 |
| Q4:用该试剂盒所能标记的IgG的最小量是多少? |
| A:IgG的最小量为10μg。IgG的量在10μg-100μg之间时,标记比率是相同的。 |
| Q5:标记产物能保存多久? |
| A:在4℃下能够保存2个月。如果需要保存更久,可以添加等量的丙三醇,并在-20℃下存放。但是,还要注意样品自身是否稳定。 |
参考文献
| 1) M. Hiyoshi, S. Suzu, Y. Yoshidomi, R. Hassan, H. Harada, N. Sakashita, H. Akari, K. Motoyoshi and S. Okada, “Interaction between Hck and HIV-1 Nef Negatively Regulates Cell Surface Expression of M-CSF Receptor”, Blood, 2008, 111(1), 243. |
| 2) W. Aung, A. Tsuji, H. Sudo, A. Sugyo, T. Furukawa, Y. Ukai, Y. Kurosawa and T. Saga, “Immunotargeting of Integrin α6β4 for Single-Photon Emission Computed Tomography and Near-Infrared Fluorescence Imaging in a Pancreatic Cancer Model”, Molecular Imaging, 2016, 15, 1. |
| 3) A. Shinya, K. Yamamoto, M. Kurata, S. Abe-Suzuki, R. Horii, F. Akiyama and M. Kitagawa, “Targeting MCM2 function as a novel strategy for the treatment of highly malignant breast tumors”, Oncotarget., 2015, 6, (33), 34892. |
| 4) K.M. Nishida, T.N. Okada, T. Kawamura, T. Mituyama, Y. Kawamura, S. Inagaki, H. Huang, D. Chen, T. Kodama, H. Siomi and M.C. Siomi, “Functional involvement of Tudor and dPRMT5 in the piRNA processing pathway in Drosophila germlines”, EMBO J.., 2009, 28, (24), 3820. |
| 5) P.G. Sreekumar, R. Kannan, M. Kitamura, C. Spee, E. Barron, S.J. Ryan and D.R. Hinton, “αB crystallin is apically secreted within exosomes by polarized human retinal pigment epithelium and provides neuroprotection to adjacent cells”, PLoS ONE., 2010, 5, (10), e12578. |
| 6) R. Asano, T. Kumagai, K. Nagai, S. Taki, I. Shimomura, K. Arai, H. Ogata, M. Okada, F. Hayasaka, H. Sanada, T. Nakanishi, T. Karvonen, H. Hayashi, Y. Katayose, M. Unno, T. Kudo, M. Umetsu and I. Kumagai, “Domain order of a bispecific diabody dramatically enhances its antitumor activity beyond structural format conversion: the case of the hEx3 diabody”, Protein Eng. Des. Sel.., 2013, 26, (5), 359. |
| 7) R. Asano, I. Shimomura, S. Konno, A. Ito, Y. Masakari, R. Orimo, S. Taki, K. Arai, H. Ogata, M. Okada, S. Furumoto, M. Onitsuka, T. Omasa, H. Hayashi, Y. Katayose, M. Unno, T. Kudo, M. Umetsu and I. Kumagai, “Rearranging the domain order of a diabody-based IgG-like bispecific antibody enhances its antitumor activity and improves its degradation resistance and pharmacokinetics”, MAbs., 2014, 6, (5), 1243. |
| 8) R. Asano, K. Ikoma, I. Shimomura, S. Taki, T. Nakanishi, M. Umetsu and I. Kumagai, “Cytotoxic enhancement of a bispecific diabody by format conversion to tandem single-chain variable fragment (taFv): the case of the hEx3 diabody”, J. Biol. Chem.., 2011, 286, (3), 1812. |
| 9) T. Toyotome, M. Yamaguchi, A. Iwasaki, A. Watanabe, H. Taguchi, L. Qin, H. Watanabe and K. Kamei, “Fetuin A, a serum component, promotes growth and biofilm formation by Aspergillus fumigatus”, Int. J. Med. Microbiol.., 2012, 302, (2), 108. |
| 10) W. Ma, V. Schubert, M. M. Martis, G. Hause, Z. Liu, Y. Shen, U. Conrad, W. Shi, U. Scholz, S. Taudien, Z. Cheng and A. Houben, “The distribution of α-kleisin during meiosis in the holocentromeric plant Luzula elegans”, Chromosome Res.., 2016, 24, (3), 393. |
| 11) Y. Yokoi, K. Nakamura, T. Yoneda, M. Kikuchi, R. Sugimoto, Y. Shimizu and T. Ayabe, “Paneth cell granule dynamics on secretory responses to bacterial stimuli in enteroids”, Sci. Rep.., 2019, 9, 2710. |
| 12) Y.J. Lee, S.R. Han, N.Y. Kim, S.H. Lee, J.S. Jeong and S.W. Lee, “An RNA aptamer that binds carcinoembryonic antigen inhibits hepatic metastasis of colon cancer cells in mice”, Gastroenterology., 2012, 143, (1), 155. |
| 13) C. F.O.Hoya, K. Kushiro, Y. Yamaoka, A. Ryo and M. Takai, ‘Rapid multiplex microfiber-based immunoassay for anti-MERS-CoV antibody detection’, Sens Biosensing Res., 2019,10.1016/j.sbsr.2019.100304. |
| 14) H. Takeuchi, N Sasaki, S. Yamaga, M. Kuboniwa, M. Matsusaki and A. Amano, “Porphyromonas gingivalis induces penetration of lipopolysaccharide and peptidoglycan through the gingival epithelium via degradation of junctional adhesion molecule 1”, PLoS Pathog., 2019, 15, (11), e1008124. |
| 15) Y. Yanase, Y. Matsuo, T. Kawaguchi, K. Ishii, A. Tanaka , K. Iwamoto , S. Takahagi and M.Hide, “Activation of Human Peripheral Basophils in Response to High IgE Antibody Concentrations without Antigens”., Int J Mol Med Sci, 2019, 20, (1), 45. |
| 16) M. Yashiro, M. Ohya, T. Mima, Y. Nakashima, K. Kawakami, T. Sonou, K. Tatsuta, Y. Yamano, S. Negi and T. Shigematsu, “Excessive ADAM17 activation occurs in uremic patients and may contribute to their immunocompromised status.”, Immun Inflamm Dis., 2020, 10.1002/iid3.298. |
| 17) H Fujishiro, H Yamamoto, N Otera, N Oka, M Jinno and S. Himeno, “In vitro Evaluation of The Effects of Cadmium on Endocytic Uptakes of Proteins into Cultured Proximal Tubule Epithelial Cells.”, Toxics, 2020, 8,10.3390/toxics8020024 |
| 18) Y. Liu, Y. Liu, X. Zheng, L. Zhao and X. Zhang, “Recapitulating and Deciphering Tumor Microenvironment by Using 3D Printed Plastic Brick–Like Microfluidic Cell Patterning”, Adv Healthc Mater, 2020, 9, (6), 1901713. |