纳米抗体特征及应用
纳米抗体是骆驼和鲨鱼中天然发现的纯重链抗体 (HcAb) 的重组可变域。纳米抗体的分子量仅为15 kDa,约为常规抗体分子量的1/10,是已知分子量最小的天然抗体。纳米抗体在结构上不同于传统抗体,表现出更高的亲和力和稳定性、微生物表达性、免疫原性低、水溶性好、组织穿透力强等特点,在疾病治疗、诊断、物质检测等领域备受关注。
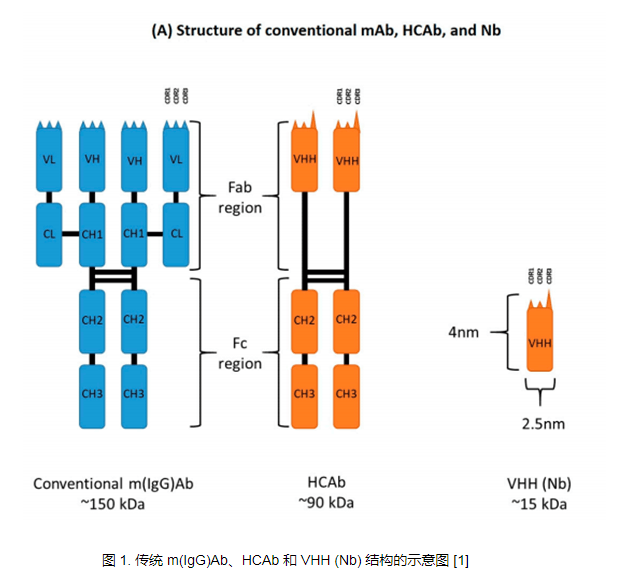
纳米抗体结构特征
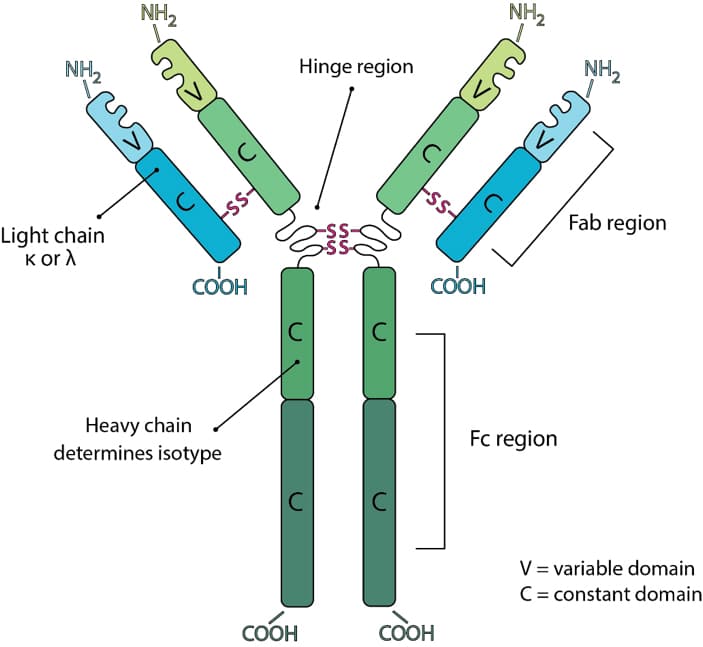
Camelid HCAb 由片段可结晶区 (Fc) 组成,该片段直接连接到由单个 VHH 结构域组成的 Fab 片段。由于缺少轻链和 CH1 区域,纳米抗体的分子量比传统单克隆抗体降低了 90 kDa。 HCAb 的 VHH 片段大小约为 2.5*4 nm,分子量约为 15 kDa,可结合广泛的抗原库。与传统抗体的可变区 (VH) 类似,纳米抗体 (Nbs) 由四个保守框架区 (FR) 和三个负责确定抗原特异性的高变互补决定区 (CDR) 组成。
同时,纳米抗体与单克隆抗体的VH片段也存在一系列差异。首先,由于缺乏轻链,纳米抗体通过三个CDR区与抗原结合,而单克隆抗体通常需要六个CDR区才能与抗原结合。在结构上,尽管不存在轻链,但纳米抗体的 CDR1 结构变异和 CDR3 长度的增加极大地促进了其抗原结合的多功能性。另外,常规mAb的VH结构域的FR2主要由疏水性氨基酸残基组成,即V37/G44/L45/W47,而纳米抗体的VH结构域的FR2通常由亲水性氨基酸残基组成,即F37/E44/R45/ G47,这也使得它们以可溶性单体的形式存在。
纳米抗体:优点和缺点
纳米抗体的结构与传统单克隆抗体相比具有多种优势。
更高的组织渗透性: mAb 的尺寸较大且 Fc 区域的存在改善了药代动力学特性,但也影响了其组织渗透能力。较小尺寸的纳米带可实现更高的组织穿透性和更强的体内细胞杀伤力。
增强的抗原识别能力:在所有互补决定区中,CDR3占抗原识别特异性的60-80%。长而延伸的CDR3环赋予了更好的抗原识别特异性和对VHH的亲和力,从而增强了对隐藏肿瘤抗原表位的识别。
稳定性强:与mAb相比,Nbs具有显着更高的热稳定性、Tm值和可逆热变性。此外,Nbs 能够抵抗蛋白酶、pH 值和疏水剂的变性作用。
能够串联成多特异性或多价配置:与 mAb 相比,Nb 的尺寸较小,有利于与多个功能不同的抗体结构域串联以实现多功能药物递送,增强亲和力,同时避免快速肾脏清除并增加药物比率。
尽管纳米抗体具有许多理想的特性,但也存在某些局限性。由于肾小球滤过的阈值是 50-60 kDa,15 kDa 的小尺寸会导致血清持续时间短或肾脏清除快,从而在诊断筛查和治疗应用中存在缺点。一种解决方案策略是将纳米抗体与聚乙二醇(PEG)或白蛋白偶联。其次,纳米抗体缺乏 Fc 区,因此无法执行与该部分相关的效应器功能。然而,这个问题可以通过与Fc区偶联来提高治疗能力来解决。
Biopharma PEG 作为的 PEG 供应商,为您的纳米抗体药物开发提供高纯度 PEG 衍生物。
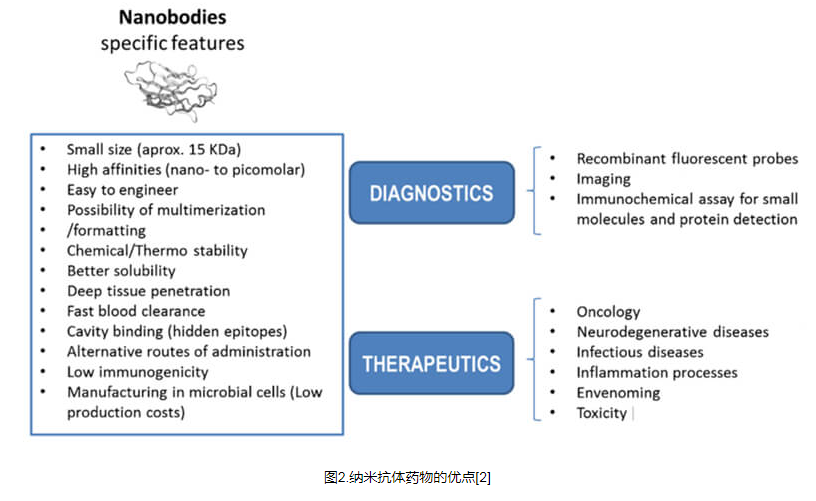
纳米抗体的应用
1. 用于诊断应用的纳米抗体
基于纳米抗体的免疫分析可以充分利用来检测和识别靶标以及临床上较难检测的外来病原体或毒素。例如,EGFR在许多肿瘤中过度表达,是肿瘤药物靶向的有吸引力的靶点。针对 EGFR 的纳米抗体已被开发并成功应用于乳腺癌、卵巢癌和前列腺癌的诊断。此外,纳米抗体还用于分子成像技术,例如用于疾病诊断的正电子发射断层扫描(PET)、单光子发射计算机断层扫描(SPECT)、近红外荧光(NIR)和超声分子成像。
2. 纳米抗体的治疗应用
纳米抗体的高亲和力和特异性使其更容易靶向结合阻塞部位的癌细胞上的受体并渗透到血管较少的组织中。同时,鉴于纳米抗体的低免疫原性,检测到对小鼠重复施用纳米抗体并没有诱导任何体液和细胞免疫反应,这对于疾病的治疗很重要。
A. 基于纳米抗体的药物递送
将纳米抗体修饰到纳米药物载体(例如,脂质体、胶束、基于白蛋白和铁蛋白的纳米粒子以及基于聚合物的多聚体)使得基于纳米抗体的抗癌药物能够主动靶向肿瘤组织。具有肿瘤特异性受体的纳米抗体可以作为将毒素或药物运送到肿瘤部位的载体,实现药物或毒素的靶向释放,减少对正常细胞的损伤,减少副作用。
B. 纳米抗体-药物偶联物 (NDC)
抗体药物偶联物 (ADC)将小分子药物的强效杀伤作用与 mAb 的高度靶向性相结合。 mAb 的大尺寸 (~150 kDa) 和 Fc 区的存在有助于改善 mAb 的药代动力学特性,但也会影响其组织渗透能力。纳米抗体(Nb)作为新型的更小、高选择性的抗体衍生物或片段,由于开发下一代靶向药物缀合物而受到广泛关注。纳米抗体药物偶联物 (NDC) 比较大的 ADC 具有优势,因为它们提供快速的全身清除、增强的稳定性和增加的肿瘤渗透率。
C. 基于纳米抗体的 CAR-T 细胞疗法
通常,单克隆抗体的单链可变片段(scFv)被用作CAR的抗原靶向结构域。然而,使用scFv作为CAR靶向结构域有一些局限性。近年来,研究人员一直关注其他类型的 CAR 结构域,包括纳米抗体、肽或配体。其中,纳米抗体作为替代的CAR靶向结构域显示出优势,包括纳米抗体的低免疫原性、高稳定性、强特异性和高亲和力,以及简单可行的开发过程。许多研究结果证实,基于纳米抗体的 CAR-T 在临床前和临床环境中都可以发挥与基于 scFv 的 CAR-T 相同的功能。