隐身型RNA载体的研发及其在新一代细胞重编程技术中的应用

常磐生物株式会社
中西真人
◆前言
通过导入基因实现的细胞重编程始于MyoD基因的发现,该基因可以将小鼠成纤维细胞(构成真皮等结缔组织的细胞)转化为肌肉细胞1)。然而,尽管许多研究人员辛勤耕耘,除了MyoD基因之外,并没有发现其他可以单独改变细胞特性的“主基因”。
2006年山中教授等人的研究表明,通过导入OCT4、SOX2、KLF4和c-MYC四种基因,可以把组成外周组织的细胞重编程为人工诱导性多能干细胞(iPS细胞)2)。这一发现有力地表明了需要组合多种因子来诱导细胞重编程,为再生医学领域带来了重大转机。目前还有多份研究报告了通过组合多种因子从而使体细胞不经由iPS细胞,直接转化为其他体细胞的直接重编程(Direct reprogramming),以及通过强制表达外源基因来诱导iPS细胞分化的定向分化(Directed differentiation)也都成为了可能。
若要将通过细胞重编程制备的细胞应用于再生医学,需使用高性能的基因导入/表达载体。若要均等地诱导重编程,必须将多个基因高效导入细胞,以一定比例稳定表达1~3周后将其从细胞中完全去除,但是能够满足这些要求的技术有限。本文将阐述目前被认为适用于细胞重编程技术的隐身型RNA载体的研发背景及应用现状。
◆使用RNA病毒的基因导入/表达载体
随着1973年磷酸钙转染法的发现,将基因导入动物细胞的方法开始作为一种实用方法逐步应用于研究领域。此后,在1980年代又开发出了至今仍被广泛使用的逆转录病毒载体、腺病毒载体、腺相关病毒(AAV)载体等重组病毒载体,以及使用正电荷脂质和DNA复合物的脂质转染法(Lipofection)等非病毒载体的基因转染法,由此提升了人们对基因治疗的期待。
另一方面,没有DNA复制中间体的RNA病毒通常具有很强的细胞毒性,因此被认为不适合作为基因导入载体(逆转录病毒和慢病毒虽然也属于RNA病毒,但与其他RNA病毒的不同之处在于其RNA通过逆转录产生的基因组cDNA会先被插入宿主的基因组DNA中再进行转录)。例如,以仙台病毒(RNA病毒的一种)为基础的载体,可以非常强烈地诱导基因表达,但由于其细胞毒性,它并不适合长期持续的表达。
笔者历经30多年,研发出一种无需将基因插入动物细胞基因组DNA即可实现持续性基因表达的RNA载体。仙台病毒中存在一种可在37°C下引起持续感染的突变株,称为Clone 151(cl.151)株3,4)。笔者着眼于这种突变病毒,与分离出cl.151毒株的吉田哲也博士(现任广岛大学名誉教授)从1988年开始共同研究此毒株。当时,PCR法和DNA测序仪还没有普及,对具有约16 kb大基因组的仙台病毒变异株的研究寸步难行,于2007年报告分离了cl.151毒株全长基因组cDNA并分析了持续感染的机制5),并于2011年成功研发出SeVdp(缺陷型和持久型仙台病毒,Defective and persistent Sendai virus)载体,该载体缺乏自主复制能力,同时可搭载4个外源基因并稳定表达6)。
研究还发现,如果将OCT4、SOX2、KLF4和c-MYC基因全部搭载至SeVdp载体,可高效重编程细胞,由此成功确立了使用持续表达型RNA病毒载体进行细胞重编程的原理。此外,还导入了一种在iPS细胞中特异性表达的miR-302自动清除载体基因组RNA的机制7),并在大量的实验室中应用于iPS细胞系的构建。
◆隐身型RNA载体的研发
通过对SeVdp载体的研究,揭示了使用RNA基因组实现稳定基因表达的必要条件。重要的是要避免干扰素诱导,在cl.151毒株中,编码RNA聚合酶的L基因突变会降低干扰素的诱导,与细胞毒性的降低有关5)。此外还发现,若编码构成病毒颗粒结构的M、F和HN基因全部缺失,不仅会降低细胞毒性,还可完全避免二次颗粒的产生6)。
另一方面,为推进将该载体应用于基因治疗和细胞重编程等领域,许多课题仍有待研究。例如,可在SeVdp载体搭载的基因结构有限,载体设计复杂,制造困难。此外,为了表达转录因子和各种受体,转录水平过高也是需要解决的问题。因此,从研发SeVdp载体的经验中吸取教训,我们着手研发更为通用的RNA载体,而研究的成果正是隐身型RNA载体(SRV)。
RNA病毒强烈诱导干扰素的原因之一在于病毒产生的RNA特性与动物细胞mRNA的特性显著不同,容易被识别为异物(病原体)。一般来说,RNA病毒的基因组RNA的GC含量较低,低于40%的不在少数。由于SeVdp载体的基因组RNA基本直接使用了天然存在的仙台病毒的遗传信息,其基因组RNA的GC含量约为46%,而人mRNA的GC含量约为60%。因为GC含量低的RNA会被细胞识别为异物8),所以我们决定通过优化密码子,使用人为增添过GC含量的RNA来重建载体。
曾有研究称在慢病毒等病毒载体中尝试了利用优化密码子来增加GC含量,但即使编码蛋白的一级结构相同,修饰后作为病毒的功能也会明显受损,因此认为病毒基因组RNA很难大规模地改变碱基序列。因此,笔者在研发SRV时,将非编码区替换为人mRNA来源的序列,同时仔细谨慎地对每个基因进行编码区优化,最终成功利用密码子优化了转录和复制所需的全部载体来源的基因。
此外,为需要搭载的基因设定了简易的规则,无论采用任何组合、顺序,都能以“转录盒”式连接法搭载至SRV中。上述改进的结果就是成功地制备出了在生理水平上表达基因的载体,同时可搭载的基因数量和大小多至10个(最长有14 kbp),大大超越了现有技术 , 可作为通用载体应用于各种目的9)。
◆可优化iPS细胞制备的隐身型RNA载体概述
SRV™ iPSC载体由常磐生物株式会社研发、富士胶片和光纯药销售,为了优化iPS细胞的制备,已采用了各种方法对其进行改进。例如,为尽可能地提高制备效率,根据作为重编程材料的细胞种类来改变载体的基因表达水平的同时,在适用于重编程血细胞的载体(SRV™ iPSC-2、SRV™ iPSC-4)中进一步改进并搭载了载体自动消除用的SeVdp-302L序列。此外,除了含有标准重编程基因组合(OCT4、SOX2、KLF4、c-MYC)的4基因搭载型载体外,还设计了额外搭载有威斯康星大学的研究组曾报告过的NANOG和LIN28两种基因的6基因型载体,实现了超高效重编程。
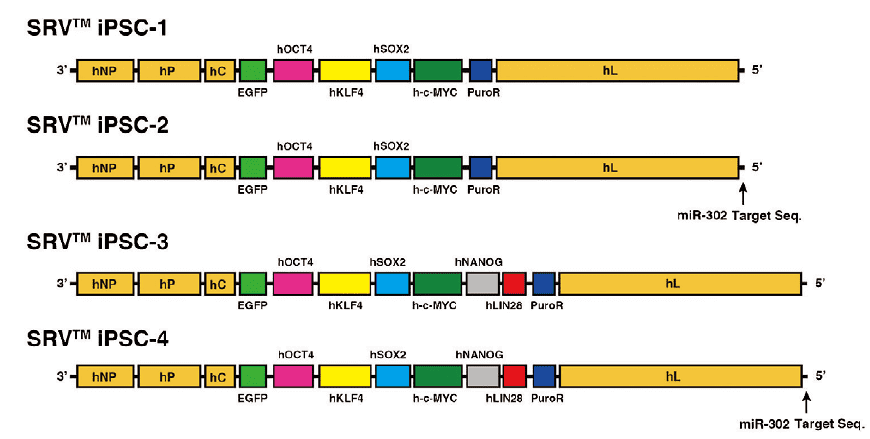
图1.SRV™ iPSC 载体的基因组结构
SRV ™ iPSC-2和SRV ™ iPSC-4具有响应miR-302后自动消除载体的系统。这种机制对于用血细胞生产iPS细胞非常有效。
此外,所有SRV ™ iPSC载体都带有发出绿色荧光的EGFP(增强型绿色荧光蛋白,Enhanced Green Fluorescent Protein)基因,作为基因表达的标志物,在重编程过程中可用荧光显微镜轻松监测基因表达(图2 )。
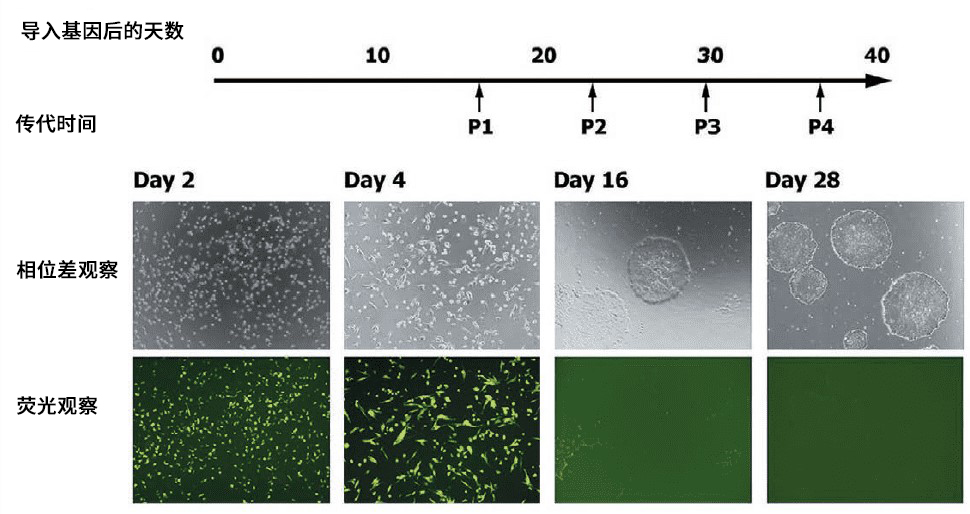
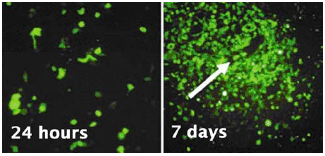
图2. 使用SRV™ iPSC-2载体从外周血单细胞中构建iPS细胞
基因导入后第4天观察到EGFP荧光,证明该基因已被导入至几乎所有细胞中并已被表达。另一方面,在发生第一次传代前的第16天,已经出现了iPS细胞的集落,但几乎观察不到EGFP的荧光,由此可以确定载体已被自动消除。
根据以上改进,SRV™ iPSC载体实现了超越现有技术的重编程效率,即使是在Xeno-free、Feeder-free的严格要求下,也都能生产高质量的iPS细胞。特别是搭载有6因子的SRV ™ iPSC载体,对于需要高质量iPS细胞的再生医学来说是非常优秀的工具,并且针对自动制备iPS细胞等的应用仍在不断地改进。此外,只需改变搭载在SRV中的基因,即可兼容直接重编程(Direct reprogramming)、定向分化(Directed differentiation)等先进的细胞重编程技术,期待它能成为未来再生医学领域中被广泛使用的工具。
◆参考文献
1)Davis, R. L. et al. : Cell, 51, 987 (1987). DOI: 10.1016/0092-8674(87)90585-x
2)Takahashi, K. and Yamanaka, S. : Cell, 126, 663 (2006). DOI: 10.1016/j.cell.2006.07.024
3)Yoshida, T. et al. : Virology, 92, 139 (1979). DOI: 10.1016/0042-6822(79)90220-4
4)Yoshida, T. et al. : Virology, 120, 329 (1982). DOI: 10.1016/0042-6822(82)90034-4
5)Nishimura, K. et al. : J. Biol. Chem., 282, 27383 (2007). DOI: 10.1074/jbc.M702028200
6)Nishimura, K. et al. : J. Biol. Chem., 286, 4760 (2011). DOI: 10.1074/jbc.M110.183780
7)Nishimura, K. et al. : Stem Cell Res., 23, 13 (2017). DOI: 10.1016/j.scr.2017.06.011
8)Vabret, N. et al. : PLoS One, 7, e33502 (2012). DOI: 10.1371/journal.pone.0033502
9)中西真人, 飯島実: 特許公報, 特許第6770224号
10)Yu, J. et al. : Science, 318, 1917 (2007). DOI: 10.1126/science.1151526
◆关键词
细胞重编程
血细胞和神经细胞都是由一个受精卵分裂且不可逆地分化细胞。由此,组成我们身体的细胞就具有了各种不同的功能和特性,一直以来人们都认为分化后的细胞其特性不会改变。然而MyoD基因的发现推翻了这一想法,揭示了分化细胞的特性可以人为改变。
持续感染
病毒与被感染的宿主细胞共存而不将宿主细胞杀死的一种感染状态。
诱导性多能干细胞(iPS细胞)
多能干细胞是指可分化成外胚层(皮肤和神经)、内胚层(消化道、肺、肝等)和中胚层(肌肉、血液等)的“多能性”细胞,在发现iPS细胞之前,更被人们熟知的是通过破坏人或动物发育过程中的胚胎而产生的胚胎干细胞(ES细胞)。然而ES细胞在破坏胚胎上存在伦理问题,若分化成ES细胞的细胞不使用免疫抑制剂就无法进行移植。另一方面,使用患者本人的细胞来制备iPS细胞,可在不发生免疫排斥的情况下进行移植,因此有望应用于再生医学。
点击此处查看相关产品:SRV™ Vector 系列

 前,基因治疗临床试验的40%都采用腺病毒载体。
前,基因治疗临床试验的40%都采用腺病毒载体。