G蛋白偶联受体ADC药物发展趋势
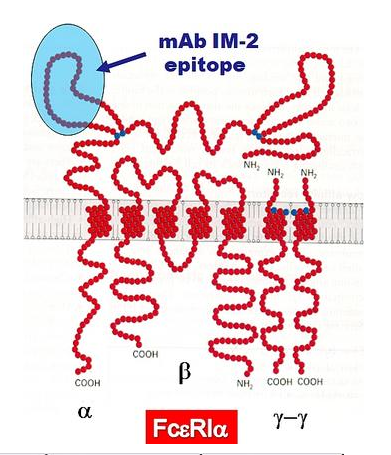
G 蛋白偶联受体 (GPCR) 是一个由七种类型的跨膜结构域蛋白组成的大家族,表达于人类细胞表面。这些分子通过启动影响大基因家族表达的信号转导途径来响应和响应外部刺激。并调节一系列重要的生理过程和功能。
没有这些蛋白质,人类就无法生存。例如,如果没有β-肾上腺素能受体,我们就无法调节血糖。没有血清素受体,我们就无法体验幸福。许多生理功能都与GPCRs调控的信号通路有关。这些途径的功能障碍会导致许多疾病。如癌症、精神疾病、糖尿病、心血管疾病、炎症性疾病等。因此,无论是基础科学研究还是医药行业,GPCR蛋白都是研究的“热点”。
抗体药物偶联物(ADC)作用机制:ADC与细胞表面靶受体结合,靶受体内化形成内体并与细胞溶酶体融合。药物从溶酶体中释放并作用于其靶标(DNA 或微管)以杀死细胞。
中国科学院上海药物研究所所长蒋华良表示:“有了GPCR,就拥有了世界”。迄今为止,GPCR蛋白家族已鉴定出800多个成员。而针对GPCRs的药物销售额占全球药物市场的27%。下面的“样本药物”列出了一些已经商业化的GPCR相关药物。其中一些是处方药,另一些在药店出售。他们拯救了许多患者的生命、减轻了痛苦并恢复了健康。
科学家利用 X 射线晶体衍射技术阐明了许多 GPCR 的原子结构。如与心血管疾病和糖尿病相关的β2-肾上腺素受体、用于癌症免疫治疗的腺苷A2A受体;免疫系统调节 CCR5 趋化因子受体 P2Y1R。与血栓性疾病相关的嘌呤能受体,以及调节行为和情绪的D3多巴胺受体。所有这些都是治疗人类疾病的重要治疗靶点的例子。它们的结构信息为后续药物开发提供了理论基础。
早在2017年的数据显示,美国食品药品监督管理局(FDA)总共批准了475种GPCR靶向药物。占美国批准的所有药物的34%。尽管市场上有如此多的此类药物,但针对这一大蛋白质家族更多成员的新药研究正变得越来越激烈。靶向GPCR药物的适应症也从高血压、过敏、麻醉、精神分裂症等传统适应症拓展到阿尔茨海默病、肥胖等新领域。目前有321个靶向GPCR正在进行临床试验,其中66个(20%)药物针对新的GPCR靶点。
除了新的GPCR靶点外,针对新旧靶点的新方法也在探索中。迄今为止,大多数针对GPCR分子的药物都是小分子和低分子量的肽。然而,与小分子和肽相比,单克隆抗体(MAb)药物具有许多优势,特别是对于肿瘤学和免疫学适应症。靶向 GPCR 的优点包括:
1.目标明确,安全性提高。 (免疫原性可能是一个安全问题,但人或人源化单克隆抗体可以大大减少这种情况)
2.体内半衰期长。
3.通过效应器功能消除靶细胞的能力。这些效应器功能包括抗体依赖性细胞介导的细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)和抗体依赖性细胞吞噬作用(ADCP)。
单域抗体、双特异性和多特异性抗体以及抗体-药物偶联物 (ADC)。这些不同类型的抗体可以靶向 GPCR 蛋白。因此,制药行业对开发针对GPCR分子的MAb药物以治疗GPCR相关疾病越来越感兴趣。至少有 74 个科学研究项目关注 37 个 GPCR 分子。共有57个单克隆抗体处于发现和临床前研究阶段,其中39个已进入临床研究。
另一种类型的 MoA 是通过所谓的效应器功能,通过抗体介导杀死表达给定受体的细胞。例如,mogamulizumab(Kyowa Hakko Kirin)经过专门设计,可增强表达 CCR4 的癌细胞的 ADCC 活性。由于 GPCR 广泛表达,并且蛋白质介导许多功能,因此经常探索针对 GPCR 的抗体用于各种甚至看似无关的适应症。
虽然单克隆抗体可以通过效应器功能杀死过度表达与其结合的抗原的癌细胞,但通过将有效的毒素附着到传统抗体药物上形成抗体-药物缀合物(ADC),可以进一步增强单克隆抗体的作用。有种杀戮的效果。 ADC与靶肿瘤细胞结合后,会被内化,然后释放结合的强力化学毒素来杀死细胞。
ADC的发展经历了20多年漫长而艰辛的过程。一路走来有很多成功和失败,通过技术创新和进步学到了很多东西。由于ADC由抗体、毒素和连接两者的连接分子三部分组成,因此与常规抗体和其他重组蛋白相比,其开发、生产和测试过程更加复杂。然而,FDA已经批准了8种ADC(上表2),其中一半是在过去一年批准的。即使在肿瘤领域之外,ADC的研发也非常活跃,目前已有8个领域的批准。
GPCR 靶点作为 ADC 药物的候选药物
尽管 GPCR 代表了已批准药物的最大蛋白靶标家族,但除某些内分泌和激素反应性肿瘤外,它们尚未广泛用作癌症治疗靶标。与此同时,尽管已经取得了巨大进展,但对开发癌症治疗新疗法的需求却在不断增加。随着人们进一步了解GPCR在癌症中的表达、结构和功能,针对GPCR的新疗法将会出现。
在癌细胞中表达增加的 GPCR 作为 ADC 靶点应该特别有吸引力。事实上,大多数 GPCR 在与配体或激动剂抗体结合后会引起构象变化,从而导致细胞内化。 GPCR 的快速内化是将其转变为有效 ADC 药物靶点的关键特征。荧光自动细胞分选 (FACS) 筛选可以帮助科学家发现具有这种激动剂特性的抗体,这些抗体可能是 ADC 的候选者。此外,某些肿瘤细胞高度表达突变的 GPCR,例如缺乏一或两个跨膜结构域的肿瘤细胞。如果能够分离出针对此类突变GPCR的特异性抗体,它们可能会发展成为有效的ADC候选药物,从而避免正常细胞表达正常的相应蛋白质。
LGR5是GPCR家族中第一个被ADC靶向的成员,在体内证明了有效的肿瘤疗效和安全性。此外,ADC 还可以减小肿瘤的大小和扩散,并在肠道肿瘤发生的基因工程模型中提高存活率。开发人员希望临床试验能够在不久的将来进一步证明他们的前景。
DS-6157 是一种针对 GPR20 的ADC 药物,GPR20 是一种在胃肠道间质瘤 (GIST) 中特异性表达的分离 GPCR。与TKI中的MoA不同,它可用于治疗对TKI治疗耐药的GIST患者。 DS-6157目前正在进行一期临床试验。
LegoChem Biosciences (LCB) 选择了三个战略性 GPCR 作为药物靶点。 LCB的技术基于位点特异性且血浆稳定的ADC平台,使用较短的额外氨基酸(CAAX)序列在抗体链末端创建位点特异性结合位点。异戊二烯转移酶将异戊二烯底物连接到 CAAX 序列的半胱氨酸残基上,创建连接子连接的结合位点。通过CAAX介导的烯丙基化,可以精确控制药物结合位点以及与抗体结合的药物数量,从而使开发人员可以获得具有明确定义的药物与抗体比率(DAR)的ADC分子。 Sorrento Therapeutics 使用这种新型 ADC 格式开发了三种针对 CCR2、CXCR3 和 CXCR5 的 GPCR。
GPCR作为ADC靶点的开发将面临许多挑战。除了GADC作为七跨膜糖蛋白的特性外,它还面临着将ADC开发为治疗剂的整体挑战。获得 GPCR 的特异性和高亲和力抗体更加困难,因为它们在普通条件下不溶,并且只有有限数量的细胞外表位来评估抗体。然而,一些公司正在开发创新策略来筛选 GPCR 特异性抗体。更新的 ADC 技术平台和 ADC 开发的成功临床经验将使这些公司能够克服相关挑战。