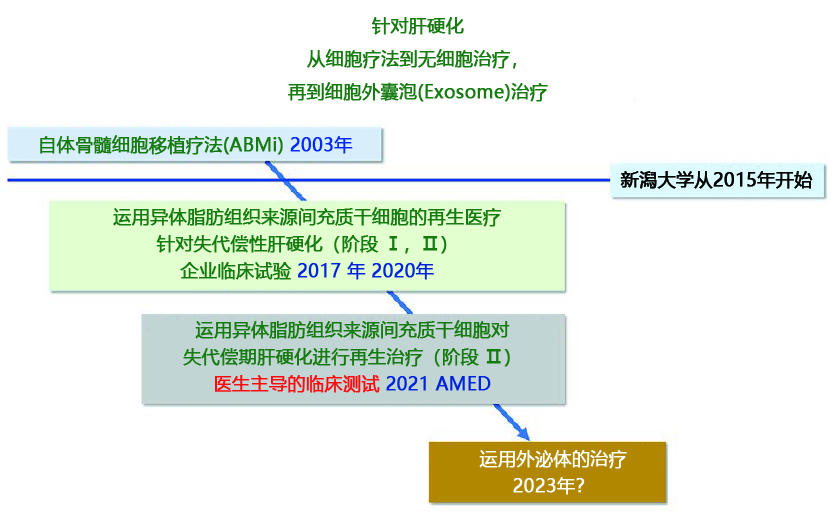
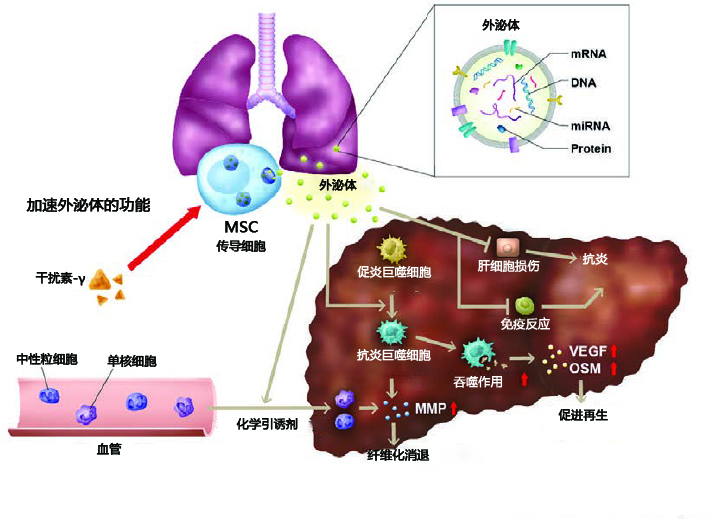
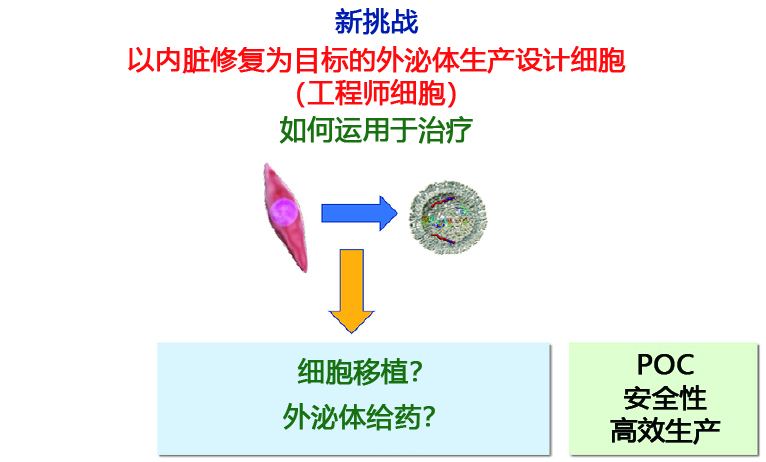
|
1.
|
Terai, S., Ishikawa, T., Omori, K., Aoyama,K., Marumoto, Y., Urata, Y., Yokoyama, Y.,Uchida, K., Yamasaki, T., Fujii, Y., Okita, K.and Sakaida, I. : Stem Cells , 24(10), 2292(2006).
|
|
2.
|
Kim, J. K., Park, Y. N., Kim, J. S., Park, M. S.,Paik, Y. H., Seok, J. Y., Chung, Y. E., Kim, H. O.,Kim, K. S., Ahn, S. H., Kim, D. Y., Kim, M. J.,Lee, K. S., Chon, C. Y., Kim, S. J., Terai, S.,Salaoda, I. and Han, K. H. : Cell Transplant. ,19(10), 1237(2010).
|
|
3.
|
Saito, T., Okumoto, K., Haga, H., Nishise, Y.,Ishii, R., Sato, C., Watanabe, H., Okada, A.,Ikeda, M., Togashi, H., Ishikawa, T., Terai,S., Sakaida, I. and Kawata, S. : Stem CellsDev ., 20(9), 1503(2011).
|
|
4.
|
Terai, S. and Tsuchiya, A. : J. Gastroenterol. ,52(2), 129(2017).
|
|
5.
|
Terai, S., Sakaida, I., Yamamoto, N., Omori,K., Watanabe, T., Ohata, S., Katada, T.,Miyamoto, K., Shinoda, K., Nishina, H. andOkita, K. : J. Biochem., 134(4), 551(2003).
|
|
6.
|
Sakaida, I., Terai, S., Yamamoto, N.,Aoyama, K., Ishikawa, T., Nishina, H. and Okita, K. : Hepatology , 40(6), 1304(2004).
|
|
7.
|
Watanabe, Y., Tsuchiya, A., Seino, S.,Kawata, Y., Kojima, Y., Ikarashi, S., Lewis,P. J. S, Lu, W. Y., Kikuta, J., Kawai, H.,Yamagiwa, S., Forbes, S. J., Ishii, M. andTerai, S. : Stem Cells Transl. Med ., 8 (3),271(2019).
|
|
8.
|
Tsuchiya, A., Takeuchi, S., Watanabe, T.,Yoshida, T., Nojiri, S., Ogawa, M. and Terai S. :Infl amm. Regen ., 39, 18(2019).
|
|
9.
|
Takeuchi, S., Tsuchiya, A., Iwasawa, T.,Nojiri, S., Watanabe, T., Ogawa, M., Yoshida, T.,Fujiki, K., Koui, Y., Kido, T., Yoshioka, Y.,Fujita, M., Kikuta, J., Itoh, T., Takamura, M.,Shirahige, K., Ishii, M., Ochiya, T., Miyajima, A.and Terai, S. : NPJ Regen. Med ., 6 (1), 19 (2021).
|
|
10.
|
Warnecke, A., Prenzler, N., Harre, J., Köhl, U.,Gärtner, L., Lenarz, T., Laner-Plamberger, S.,Wietzorrek, G., Staecker, H., Lassacher, T.,Hollerweger, J., Gimona, M. and Rohde, E. :J. Extracell. Vesicles , 10(8), e12094(2021).
|