- 产品特性
- 相关资料
- Q&A
- 参考文献
Stemgent干细胞分化试剂
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |

间充质干细胞抑制 CAR-T 杀伤淋巴瘤细胞的功效
用于干细胞培养的耐热 FGF2介绍
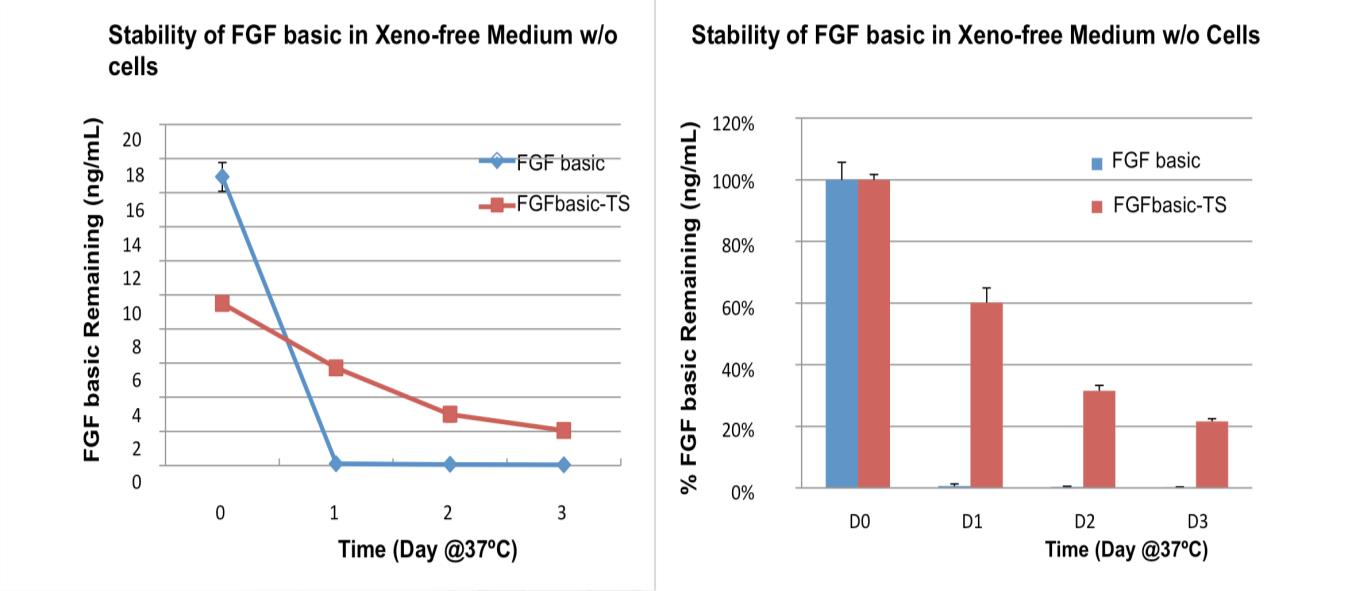
干细胞培养中需要 FGF2(也称为 FGF-basic 或 bFGF)来维持干细胞处于未分化和多能状态。然而,FGF basic 不稳定,需要每天更换培养基并添加新的 FGF basic,这是昂贵、乏味且耗时的。为了克服这个问题,开发了 FGF basic 的热稳定版本,以支持 2 天介质更换协议,而不是每日介质更换。为期 2 天的培养基更换方案使干细胞研究人员无需在周末返回实验室,使其成为干细胞研究人员的理想选择。耐热 FGF2 经过精心设计,可增强在培养基中的稳定性,而不影响其生物学功能。
当在 37° 的典型干细胞培养基中培养时,培养 2 天后,相当数量 (35%) 的热稳定 FGF2 (SPEED SKU# SDP1025) 在培养基中保持完整,而常规 FGF2 (SPEED SKU# YCP1143)第一天后就无法检测到。结果表明,热稳定 FGF2 的降解速度比常规 FGF 碱性慢约 3 倍。
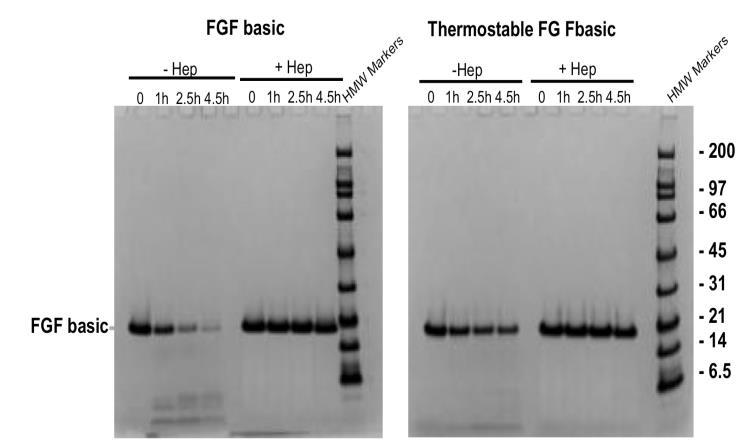
当暴露于胰蛋白酶时,FGF2 在 4.5 小时后显着降解,而 FGF2-TS(热稳定)水平仅略有降低。值得注意的是,肝素可保护 FGF2 和 FGF2-TS 免受胰蛋白酶消化。与 FGF basic 相比,热稳定 FGF basic 更能抵抗蛋白水解降解。
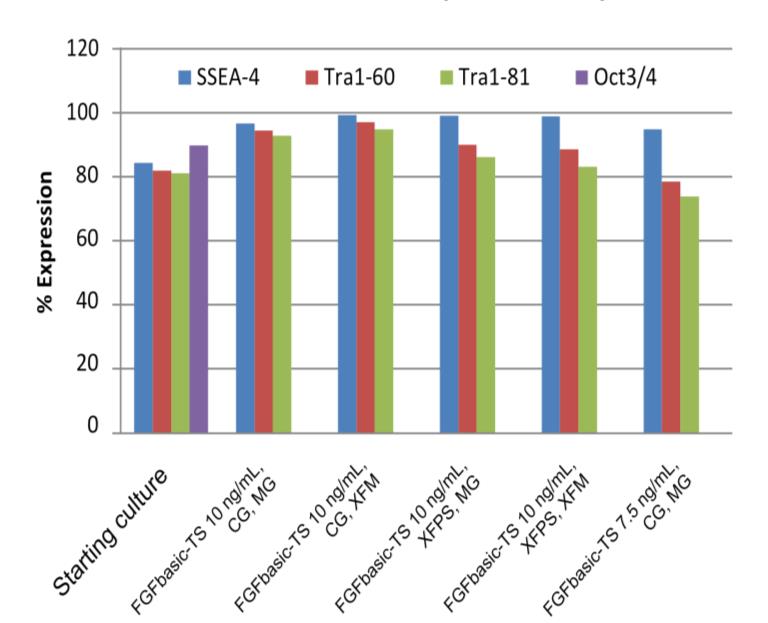
采用两天喂养方案,无论细胞是人胚胎干细胞(hESC)还是诱导多能干细胞(iPSC),干细胞的多能性在传代10次后都能得到有效维持;使用非酶传代溶液 (XFPS) 或使用胶原基试剂 (CG) 进行传代;在化学成分确定的基质 (XFM) 或基质胶 (MG) 中培养。通过对干细胞标记物(包括 SSEA-4、Tra1-60、Tra1-81 和 Oct3/4)进行细胞计数分析来证实多能性。
通过两天的喂养方案,iPSC 细胞培养物即使在传代 10 次后仍保持健康的生长特性。下图分别显示了培养第2天和第6天的iPS细胞。

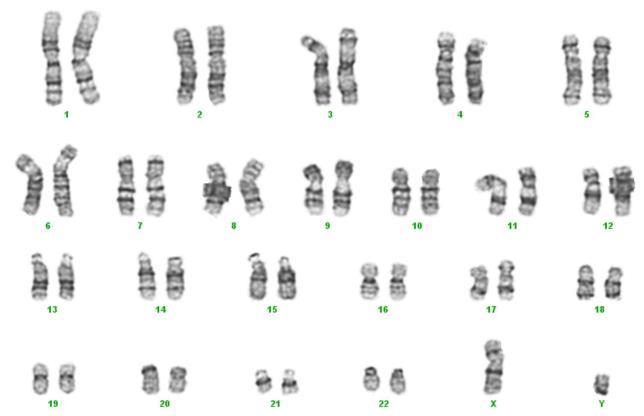
干细胞培养物在长期培养过程中会出现遗传异常。在使用 10 mg/mL FGFbasic-TS 的 2 天喂养计划中,iPS 细胞系在第 10 次传代后在核型分析中保持正常。
BOC Sciences干细胞分子简介
干细胞是一种特殊的细胞,具有自我更新能力,能产生至少一个高度分化的子细胞。近年来,以干细胞技术为代表的再生医学迅速崛起。随着基础医学的发展,越来越多的生物活性小分子被证实具有调节干细胞命运的作用。由于具有高选择性、良好的细胞渗透性和稳定的理化性质等优势,小分子被应用于干细胞生物学领域,包括诱导分化、重编程和转分化。
干细胞在体外的扩增和分化通常需要额外的生长因子和信号分子。研究证明,小分子可以选择性地激活或抑制特定的发育信号通路,因此它们可以替代昂贵的生长因子来诱导多能干细胞分化成特定类型的细胞。例如,抗坏血酸可以有效增强胚胎干细胞分化为心肌细胞,间充质干细胞(MSCs)在地塞米松、β甘油磷酸钠和维生素C的共同作用下可以分化成成骨细胞。 与传统技术体系相比,小分子诱导的干细胞分化技术更安全、更简单,更易于规范和调控。
将终末分化的成体细胞逆转为多能细胞甚至全能细胞的方法称为体细胞重编程或只是重编程。2006年,Shinya Yamanaka证明,通过将四种因子(Oct3 / 4,Sox2,c-Myc和Klf4)引入小鼠成纤维细胞可以获得诱导多能干细胞(iPSC)。虽然这项技术推动干细胞研究进入了一个新的时代,但它仍然存在潜在的风险,如致瘤性。2013年,邓洪奎证实,使用七种小分子的组合可以诱导小鼠体细胞重编程为多能干细胞,也称为化学诱导多能干细胞(CiPSCs)。
转分化,也称为谱系重编程,是一个成熟的体细胞转化为另一个成熟的体细胞而不经历中间多能状态或祖细胞类型的过程。这项技术为疾病建模和分子替代疗法的开发带来了全新的思路。例如,在2015年,谢欣的小组使用六种小分子的组合在体外成功地将小鼠尾尖成纤维细胞转分化为心肌细胞。这些化学诱导的心肌样细胞(CiCMs)可以有节奏地自动收缩,表达心脏特异性基因,并具有与心肌细胞相似的电生理特征。
干细胞的转染
很多时候,进行细胞转染的研究人员必须进行谨慎的平衡。实现足够高的转染水平以提供可靠的结果,同时又不在此过程中杀死太多细胞,是一项持续的斗争。对于从事干细胞研究的科学家来说,这些问题更具挑战性,因为它们的转染率历来较低(通常低于5%)。
许多科学家现在正在寻求利用干细胞进行基于CRISPR的基因编辑,以在细胞水平上对疾病产生新的理解。有一种高效可靠的方法来转染干细胞,以实现基因组编辑的新发现,这一点从未如此重要。现在非常需要针对CRISPR应用优化干细胞转染方案。允许干细胞维持其多能状态并最大限度地减少转染的细胞毒性的方案至关重要。
我们的支链两亲性肽胶囊(BAPC™)克服了脂质体载体的问题,有助于最大限度地减少转染干细胞的压力。这与诱导多能干细胞(iPSCs)尤其相关,它们对环境变化非常敏感,对压力反应不佳。

将荧光激活细胞分选 (FACS) 分选的干细胞(辐射敏感细胞)培养 6 小时,并与 BAPC 和 Atto 633 一起孵育过夜。然后用固定在 4% FFA 中的培养基洗涤细胞两次。 DMSO 处理的细胞用作阴性对照。在上图中,比例尺代表 10 微米,白色箭头代表 BAPC 阳性细胞。
Phoreus™ BAPtofect™-25 细胞转染试剂盒最大限度地减少了干细胞转染的压力。由于 BAPC 是由合成的、天然存在的肽构成的,它们是自组装的、水溶性的、对细胞无毒,并且不会触发免疫系统反应。
Phoreus目前正在与行业合作伙伴合作开发iPSC干细胞转染的新方案。 虽然这项初步工作已经成功地证明了干细胞对染色BAPC的有效吸收,但目前正在进行研究,以证明核酸的保护递送导致干细胞成功转化。这些新协议将促进CRISPR Cas-9的递送,并指导RNA用于干细胞中的基因编辑,从而在细胞水平上对疾病产生令人兴奋的新理解。